
Wetenschap
Hoe beïnvloedt een zuur de pH H plus-concentratie wanneer het aan water wordt toegevoegd?
Zuren doneren H+-ionen wanneer ze in water worden opgelost, wat leidt tot een toename van hun concentratie in de oplossing. Deze toename van de H+-ionenconcentratie verschuift de pH naar lagere waarden, waardoor de oplossing zuurder wordt. De mate van de pH-verandering hangt af van de sterkte van het zuur en de concentratie waarin het wordt toegevoegd. Sterke zuren dissociëren volledig in water, waarbij een groot aantal H+-ionen vrijkomt, en veroorzaken bijgevolg een significantere daling van de pH. Zwakke zuren dissociëren daarentegen gedeeltelijk, waardoor minder H+-ionen vrijkomen en een kleinere pH-verandering ontstaat.
De relatie tussen pH en H+-ionenconcentratie is logaritmisch. Dit betekent dat een kleine verandering in de pH overeenkomt met een significante verandering in de H+-ionenconcentratie. Een verlaging van de pH van 7 naar 6 vertegenwoordigt bijvoorbeeld een tienvoudige toename van de H+-ionenconcentratie. Op dezelfde manier vertegenwoordigt een verhoging van de pH van 7 naar 8 een tienvoudige afname van de H+-ionenconcentratie.
 Antarctische ijsplaten kwetsbaar voor plotselinge door smeltwater veroorzaakte breuken, zegt studie
Antarctische ijsplaten kwetsbaar voor plotselinge door smeltwater veroorzaakte breuken, zegt studie De aardbeving in Kaikoura kan ertoe leiden dat de modellen voor aardbevingsgevaar internationaal worden heroverwogen
De aardbeving in Kaikoura kan ertoe leiden dat de modellen voor aardbevingsgevaar internationaal worden heroverwogen Uitdunnen en voorgeschreven brandbehandelingen verminderen de boomsterfte
Uitdunnen en voorgeschreven brandbehandelingen verminderen de boomsterfte Groot-Brittannië keurt 2050 netto nul-emissiedoelstelling goed
Groot-Brittannië keurt 2050 netto nul-emissiedoelstelling goed Algenbloei die schadelijk is voor de aquacultuur:wereldwijde beoordeling van de VN
Algenbloei die schadelijk is voor de aquacultuur:wereldwijde beoordeling van de VN
Hoofdlijnen
- DNA-onderzoek van de beroemde Amerikaanse sledehond laat zien wat hem zo stoer maakte
- Geluid onthult dat gigantische blauwe vinvissen met de wind dansen om voedsel te vinden
- Welke vier dingen maken ribosomen anders dan organellen?
- Voorkeuren voor het eten van insecten voorspellen na ontbossing
- Na honderden jaren bevestigt onderzoek dat Bermuda nu de thuisbasis is van koeneusroggen
- Vroegtijdige waarschuwing gezondheids- en welzijnssysteem kan boeren miljoenen ponden besparen
- Wat 3000 jaar oude Egyptische tarwe ons vertelt over de genetica van ons dagelijks brood
- Studie maakt ingang naar landbouw zwanenhals zeepokken
- Voor melkveehouders, waar blijft de tijd?
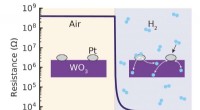
- Een waterstofsensor die werkt bij kamertemperatuur
- Chaperones bereiden eiwitten gewoon voor om zelf te vouwen
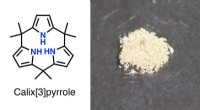
- Pyrroolchemie:goede dingen komen in drieën
- Licht en peptiden:nieuwe methode diversifieert natuurlijke bouwstenen van het leven

- Periodiek systeem ontdekt in St. Andrews erkend als oudste ter wereld

 In welk soort klimaat is nootmuskaat geteeld?
In welk soort klimaat is nootmuskaat geteeld?  10 grootste sneeuwstormen aller tijden
10 grootste sneeuwstormen aller tijden  Eerste film over zonsverduistering ooit weer tot leven gebracht
Eerste film over zonsverduistering ooit weer tot leven gebracht Nanodeeltjes zijn veelbelovend voor de behandeling van darmontsteking, studie vondsten
Nanodeeltjes zijn veelbelovend voor de behandeling van darmontsteking, studie vondsten Welk paar bestaat uit een zwak zuur en een sterke base?
Welk paar bestaat uit een zwak zuur en een sterke base?  Microben in ondergrondse watervoerende lagen onder de diepzee Mid-Atlantische Rug eten van koolstof
Microben in ondergrondse watervoerende lagen onder de diepzee Mid-Atlantische Rug eten van koolstof De hoofdstad van Zimbabwe droogt op door het afsluiten van de kraan voor 2 miljoen mensen
De hoofdstad van Zimbabwe droogt op door het afsluiten van de kraan voor 2 miljoen mensen Kinderen droegen videocamera's in hun kleuterklas, voor de wetenschap
Kinderen droegen videocamera's in hun kleuterklas, voor de wetenschap
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

