
Wetenschap
Wat is het verschil tussen reactieve en niet-metalen?
Reactiviteit:
Reactieve metalen zijn zeer reactief, wat betekent dat ze gemakkelijk deelnemen aan chemische reacties. Niet-reactieve metalen, ook wel edelmetalen genoemd, zijn minder reactief en zijn doorgaans stabieler in hun zuivere vorm.
Corrosie:
Reactieve metalen zijn gevoelig voor corrosie vanwege hun hoge reactiviteit. Ze reageren gemakkelijk met zuurstof, water of andere stoffen in hun omgeving, waarbij ze oxiden of andere verbindingen vormen. Niet-reactieve metalen zijn daarentegen bestand tegen corrosie en vormen niet gemakkelijk dergelijke verbindingen.
Glans:
Reactieve metalen hebben doorgaans een glanzend, glanzend uiterlijk vanwege hun vermogen om licht te reflecteren. Niet-reactieve metalen hebben ook een glanzend uiterlijk, maar hun glans is doorgaans duurzamer omdat ze minder gevoelig zijn voor aanslag en corrosie.
Hardheid:
Reactieve metalen zijn over het algemeen zachter vergeleken met niet-reactieve metalen. Hun kristalstructuren zijn doorgaans minder strak op elkaar gepakt, waardoor ze gemakkelijker te vervormen of te snijden zijn. Niet-reactieve metalen zijn daarentegen vaak harder omdat ze dichter op elkaar gepakte kristalstructuren hebben.
Geleidbaarheid:
Reactieve metalen zijn over het algemeen goede geleiders van elektriciteit en warmte. De losjes gebonden valentie-elektronen in reactieve metalen zorgen voor een gemakkelijkere beweging van elektronen, waardoor een efficiënte energieoverdracht wordt vergemakkelijkt. Niet-reactieve metalen zijn ook goede geleiders, maar kunnen vanwege hun sterkere bindingen een iets lagere geleidbaarheid hebben.
Elektronconfiguraties:
Reactieve metalen hebben onvolledige buitenste elektronenschillen, waardoor ze graag elektronen willen verliezen en stabiliteit willen bereiken. Deze elektronenconfiguratie drijft hun hoge reactiviteit aan. Niet-reactieve metalen hebben daarentegen volledige buitenste elektronenschillen, waardoor het minder waarschijnlijk is dat ze elektronen verliezen of winnen, vandaar hun lagere reactiviteit.
Voorbeelden:
Reactieve metalen omvatten natrium (Na), kalium (K), calcium (Ca), ijzer (Fe) en aluminium (Al). Voorbeelden van niet-reactieve metalen zijn goud (Au), zilver (Ag), platina (Pt) en iridium (Ir).
Samenvattend kunnen we stellen dat reactieve metalen zeer reactief zijn, gevoelig voor corrosie, een glanzend uiterlijk hebben, relatief zachter zijn en goede geleiders van elektriciteit en warmte zijn. Niet-reactieve metalen daarentegen zijn minder reactief, corrosiebestendig, glanzend, harder en ook goede geleiders van elektriciteit en warmte.
 Studie vindt diepe ondergrondse verbinding tussen twee Japanse vulkanen
Studie vindt diepe ondergrondse verbinding tussen twee Japanse vulkanen Nieuwe VN-tool brengt overstromingen sinds 1985 in kaart tot straatniveau, zal helpen bij het plannen van rampen, vooral in Global South
Nieuwe VN-tool brengt overstromingen sinds 1985 in kaart tot straatniveau, zal helpen bij het plannen van rampen, vooral in Global South Op een klimaatachtbaan:hoe het Australische milieu het deed in het warmste jaar ter wereld
Op een klimaatachtbaan:hoe het Australische milieu het deed in het warmste jaar ter wereld  2017 wordt het heetste niet-El Nino-jaar:UN
2017 wordt het heetste niet-El Nino-jaar:UN Modellering onthult dynamiek van klimaatverandering, verstedelijking en warmtebeperkende technologieën
Modellering onthult dynamiek van klimaatverandering, verstedelijking en warmtebeperkende technologieën
Hoofdlijnen
- Waarin verschilt de mechanische methode van onkruidbestrijding van de biologische methode?
- Als het gaat om de strijd tegen klimaatverandering, zegt Californië dat de bever eens moet worden overwogen
- Wat zijn de stikstofbasen in RNA die verschillen van dat DNA?
- Wat denk je dat er met een dierlijke cel zal gebeuren als het membraan barst, zou hetzelfde gebeuren met een plantencel?
- Hoe het placebo-effect werkt
- Wat zijn de functies en organen van het integumentumsysteem?
- Waarom is het zo moeilijk om salmonella uit te roeien?
- Beschrijf de kenmerken van Miss Phatuphats en leg uit?
- Eten of helpen zebramosselen giftige algen?
- Selectieve synthese van meta-isomeren nu mogelijk
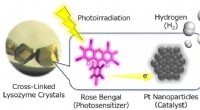
- Wetenschappers gebruiken eiwitten voor de productie van schone energie
- Video:hoe Xanax werkt

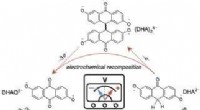
- Onderzoek verlengt de levensduur van moleculen in organische stroombatterijen tot praktische waarden
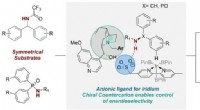
- Door metaal gekatalyseerde reacties die enantioselectief zijn gemaakt met behulp van chiraal kation
 Hoe kan ik Tds converteren naar geleidbaarheid
Hoe kan ik Tds converteren naar geleidbaarheid  Gehele getallen omzetten in percentages
Gehele getallen omzetten in percentages Welk soort materiaal mag je NIET gebruiken om je te beschermen tegen bètastraling?
Welk soort materiaal mag je NIET gebruiken om je te beschermen tegen bètastraling?  Zeewering bouwen is een kleine pleister op een gapende wond
Zeewering bouwen is een kleine pleister op een gapende wond Wanneer een gestrekte snaar wordt losgelaten, wordt de potentiële energie omgezet in?
Wanneer een gestrekte snaar wordt losgelaten, wordt de potentiële energie omgezet in?  Bioloog bedenkt manier om Mardi Gras groener te maken
Bioloog bedenkt manier om Mardi Gras groener te maken Bacteriële biofilms gebruiken voor de productie van nieuwe zelfherstellende materialen en bioprocessing-technologieën
Bacteriële biofilms gebruiken voor de productie van nieuwe zelfherstellende materialen en bioprocessing-technologieën Onderzoekers onderzoeken de dynamiek van vloeibare metaaldeeltjes op nanoschaal
Onderzoekers onderzoeken de dynamiek van vloeibare metaaldeeltjes op nanoschaal
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

