
Wetenschap
Is het SCl2-molecuul polair of niet-polair?
De elektronegativiteit van zwavel is 2,58, terwijl de elektronegativiteit van chloor 3,0 is. Dit betekent dat chlooratomen een hogere elektronegativiteit hebben dan zwavel. Als gevolg hiervan worden de elektronen in de S-Cl-bindingen meer naar de chlooratomen getrokken, waardoor een gedeeltelijke negatieve lading op de chlooratomen ontstaat en een gedeeltelijke positieve lading op het zwavelatoom.
Het verschil in elektronegativiteit tussen zwavel en chloor is 0,42 (3,0 - 2,58). Deze waarde is significant genoeg om een polaire binding te creëren. Omdat het molecuul echter een lineaire vorm heeft, heffen de twee polaire S-Cl-bindingen elkaar op, wat resulteert in een niet-polair molecuul.
Daarom is SCl2 een niet-polair molecuul.
 Team meet het verbreken van een enkele chemische binding
Team meet het verbreken van een enkele chemische binding Het ontsmetten van industrieel plastic afval om de planeet te ontlasten
Het ontsmetten van industrieel plastic afval om de planeet te ontlasten Wat is het oxidatiegetal van C in glucose?
Wat is het oxidatiegetal van C in glucose?  IJsbestendige coating voor grote constructies is afhankelijk van een prachtige demonstratie van mechanica
IJsbestendige coating voor grote constructies is afhankelijk van een prachtige demonstratie van mechanica Wat gebeurt er als je zilvernitraat toevoegt aan gedestilleerd water en een zoutoplossing?
Wat gebeurt er als je zilvernitraat toevoegt aan gedestilleerd water en een zoutoplossing?
 Elektriciteitsbron bepaalt voordelen van elektrische voertuigen in China
Elektriciteitsbron bepaalt voordelen van elektrische voertuigen in China Methaanbronnen in Parijs in kaart brengen
Methaanbronnen in Parijs in kaart brengen Klimaatverandering:een veelbelovende toekomst voor katoen in Kameroen?
Klimaatverandering:een veelbelovende toekomst voor katoen in Kameroen?  VERKLARER:Ida lijkt op Katrina, maar sterker, kleiner
VERKLARER:Ida lijkt op Katrina, maar sterker, kleiner Wat als de dinosaurussen niet waren uitgestorven? Waarom onze wereld er heel anders uit zou kunnen zien
Wat als de dinosaurussen niet waren uitgestorven? Waarom onze wereld er heel anders uit zou kunnen zien
Hoofdlijnen
- Kunnen inheemse bijen, nu de kolonies van honingbijen instorten, de bestuiving aan?
- Bloem of vlees? Genetica verklaart de voorkeur van muggen
- Onderzoekers ontdekken een nieuwe laag genetische informatie die helpt bepalen hoe snel eiwitten worden geproduceerd
- Handheld DNA-sequencers zijn veelbelovend voor het monitoren van microben tijdens de voedselproductie
- Hoe vissen aan hun stekels kwamen
- Bacteriën coderen voor verborgen genen buiten hun genoom; wij?
- Wat zijn draadachtige structuren in een celkern die genen bevat?
- Cellen gestrest? Maak de mitochondriën langer
- Hoe cellen in vorm blijven
- Gebrouwen koffiedik biedt duurzaam alternatief voor kledingverf

- Vooruitgang in de richting van het aansluiten van een antibioticapomp

- Onderzoekers ontwikkelen nieuwe methode voor levering van glucagon

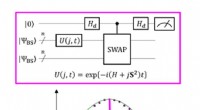
- Spinchemie heroverwegen vanuit een kwantumperspectief
- Veelgebruikte medicijnbron voor inzichten in de vorming van vlinderkristallen
 Wat zijn de resulterende producten van het splitsen van water bij fotosynthese?
Wat zijn de resulterende producten van het splitsen van water bij fotosynthese?  Snelle veranderingen in aangeslagen moleculen opvangen
Snelle veranderingen in aangeslagen moleculen opvangen Een litteken dat de Woolsey Fire achterliet
Een litteken dat de Woolsey Fire achterliet Welke gevolgen zal de klimaatverandering hebben voor kariboes en rendieren in het Noordpoolgebied?
Welke gevolgen zal de klimaatverandering hebben voor kariboes en rendieren in het Noordpoolgebied?  Wetenschappers onthullen nieuwe satellietgebaseerde wereldwijde droogte-ernstindex
Wetenschappers onthullen nieuwe satellietgebaseerde wereldwijde droogte-ernstindex Online leren straft minderheidsstudenten, maar videochats kunnen helpen
Online leren straft minderheidsstudenten, maar videochats kunnen helpen Nieuw papier biedt doorbraak op het gebied van knipperende moleculen
Nieuw papier biedt doorbraak op het gebied van knipperende moleculen Hoe worden regenbogen gevormd? De wetenschap achter de kleuren
Hoe worden regenbogen gevormd? De wetenschap achter de kleuren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

