
Wetenschap
Hoeveel covalente bindingen heeft koolstof nodig om de buitenste schil te creëren?
Koolstof moet vier covalente bindingen vormen om zijn buitenste schil te voltooien. Dit komt omdat koolstof vier valentie-elektronen heeft, dit zijn de elektronen in de buitenste schil van een atoom die deelnemen aan chemische bindingen. Wanneer koolstofatomen zich binden met andere atomen, delen ze hun valentie-elektronen om een stabiele elektronenconfiguratie te bereiken. Koolstofatomen kunnen hun valentie-elektronen op verschillende manieren delen, maar de meest gebruikelijke manier is door covalente bindingen te vormen. In een covalente binding delen twee atomen een of meer elektronenparen. Wanneer koolstof een covalente binding vormt, deelt het een van zijn valentie-elektronen met een ander atoom, en dat atoom deelt een van zijn valentie-elektronen met koolstof. Hierdoor ontstaat er een sterke binding tussen de twee atomen en kan koolstof een stabiele elektronenconfiguratie bereiken.
 Onderzoekers ontdekken de kunst van het feilloos printen van extreem harde staalsoorten
Onderzoekers ontdekken de kunst van het feilloos printen van extreem harde staalsoorten Chemici bevorderen het vermogen om chemische reacties te beheersen
Chemici bevorderen het vermogen om chemische reacties te beheersen Welke van deze chemische elementen wordt in alle organische moleculen aangetroffen?
Welke van deze chemische elementen wordt in alle organische moleculen aangetroffen?  Een eenstaps multikatalytische methode om racemische mengsels te verrijken tot een enkele enantiomeer
Een eenstaps multikatalytische methode om racemische mengsels te verrijken tot een enkele enantiomeer Mengt calciumcarbide en water?
Mengt calciumcarbide en water?
 Schotland zegt nee tegen fracken
Schotland zegt nee tegen fracken Vraag en antwoord:Hoe het mensenrecht op een gezonde omgeving ons allemaal kan helpen beschermen
Vraag en antwoord:Hoe het mensenrecht op een gezonde omgeving ons allemaal kan helpen beschermen Rewilding:zeldzame vogels keren terug als het grazen van vee is gestopt
Rewilding:zeldzame vogels keren terug als het grazen van vee is gestopt Hoe mensen steden en voorsteden waarnemen is niet louter een kwestie van grenslijnen
Hoe mensen steden en voorsteden waarnemen is niet louter een kwestie van grenslijnen  Eerste directe waarnemingen van methaan dat het broeikaseffect aan het aardoppervlak vergroot
Eerste directe waarnemingen van methaan dat het broeikaseffect aan het aardoppervlak vergroot
Hoofdlijnen
- Onderzoekers laten voor het eerst bewuste processen zien in de hersenen van vogels
- Onderzoek ontkracht de mythe dat rashonden vatbaarder zijn voor gezondheidsproblemen
- De kern van een cel coördineert processen en activiteiten die in de cel plaatsvinden. welke twee systemen vervullen een soortgelijke functie in het menselijk lichaam?
- Soorten genetische kruisen
- Convergente evolutie:wanneer een goed idee tussen soorten beweegt
- Onderzoekers laten zien hoe alternatieven voor vismeel en olie de groei van de aquacultuur kunnen ondersteunen
- Zoogdier waarvan lang gedacht werd dat het uitgestorven was in Australië duikt weer op
- Hoe bloedvlekpatroonanalyse werkt
- Onderzoekers onderzoeken systematisch de werkzaamheid van CRISPR-antimicrobiële middelen
- Cellulose:een altijd aanwezig materiaal met opmerkelijke eigenschappen
- Reductie zorgt voor schonere en efficiëntere katalytische reacties

- Ontdekking kan nucleair afval verminderen met een verbeterde methode om moleculen chemisch te ontwikkelen

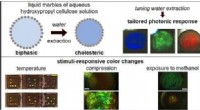
- De borstelharen van polyelektrolytborstels opfleuren en krimpen
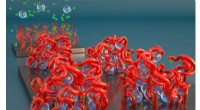
- Geïntegreerde waterstofopslag voor brandstofcelauto's

 Microsofts anti-hacking-inspanningen maken het een internetagent
Microsofts anti-hacking-inspanningen maken het een internetagent Gebruikmaken van de perceptie van wetenschappers voor succesvolle interacties met beleidsmakers
Gebruikmaken van de perceptie van wetenschappers voor succesvolle interacties met beleidsmakers Goedkoop, eenvoudige fabricagemethode klaar om microlenstoepassingen uit te breiden
Goedkoop, eenvoudige fabricagemethode klaar om microlenstoepassingen uit te breiden Hebben we piekolie bereikt?
Hebben we piekolie bereikt?  Op Californië, de droogte en de bah-factor
Op Californië, de droogte en de bah-factor Kunnen twee NASA-astronauten tot volgend jaar vastzitten in het ruimtestation? Een beslissing is aanstaande
Kunnen twee NASA-astronauten tot volgend jaar vastzitten in het ruimtestation? Een beslissing is aanstaande  Vooruitgang en uitdagingen bij het begrijpen van samengestelde weers- en klimaatextremen
Vooruitgang en uitdagingen bij het begrijpen van samengestelde weers- en klimaatextremen  Turkije heft verbod op Wikipedia op
Turkije heft verbod op Wikipedia op
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

