
Wetenschap
Wat is een zuur volgens Arrhenius?
Deze definitie werd eind 19e eeuw voorgesteld door de Zweedse chemicus Svante Arrhenius en was een belangrijke stap voorwaarts in ons begrip van zuren en basen. Het zorgde voor een preciezere en meetbare manier om zuren te definiëren en legde de basis voor verdere ontwikkelingen op het gebied van de zuur-base-chemie.
Voorbeelden van zuren volgens de Arrhenius-definitie zijn zoutzuur (HCl), zwavelzuur (H2SO4) en salpeterzuur (HNO3). Deze zuren geven, wanneer ze in water worden opgelost, H+-ionen vrij, wat leidt tot hun karakteristieke zure eigenschappen.
De Arrhenius-definitie was destijds baanbrekend, maar is in de loop der jaren uitgebreid en verfijnd, vooral met de introductie van de Bronsted-Lowry-definitie en de Lewis-definitie van zuren. Deze definities bieden een uitgebreidere verklaring van het zuur-base-gedrag en worden in de moderne chemie vaak naast de Arrhenius-definitie gebruikt.
 Wat staat er in de tweede kolom van het periodiek systeem?
Wat staat er in de tweede kolom van het periodiek systeem?  Wetenschappers ontwikkelen gel gemaakt van spinnenzijde-eiwitten voor biomedische toepassingen
Wetenschappers ontwikkelen gel gemaakt van spinnenzijde-eiwitten voor biomedische toepassingen Geneesmiddelgeïnduceerde celmembraancomplexen induceren de dood van kankercellen
Geneesmiddelgeïnduceerde celmembraancomplexen induceren de dood van kankercellen Onderzoekers ontdekken superelastisch materiaal met vormgeheugen
Onderzoekers ontdekken superelastisch materiaal met vormgeheugen Uitvinding biedt nieuwe optie voor het bewaken van de gezondheid van het hart
Uitvinding biedt nieuwe optie voor het bewaken van de gezondheid van het hart
 Uitbreiding van gaswinning bedreigt ons klimaat, water en gezondheid
Uitbreiding van gaswinning bedreigt ons klimaat, water en gezondheid Hevige aardbeving doet Taiwan in rep en roer, waarbij 9 mensen om het leven komen en meer dan 1.000 gewond raken
Hevige aardbeving doet Taiwan in rep en roer, waarbij 9 mensen om het leven komen en meer dan 1.000 gewond raken  Wat is een deltaland vorm?
Wat is een deltaland vorm?  Uit onderzoek blijkt dat 17 bergen een groot risico lopen om biodiversiteit te verliezen als gevolg van de klimaatverandering
Uit onderzoek blijkt dat 17 bergen een groot risico lopen om biodiversiteit te verliezen als gevolg van de klimaatverandering  Orkaan Douglas raast over Hawaï terwijl pandemie oplaait
Orkaan Douglas raast over Hawaï terwijl pandemie oplaait
Hoofdlijnen
- Onderzoekers karakteriseren muggengenen om te leren hoe insecten zich verdedigen tegen parasieten die malaria veroorzaken
- Onderzoek toont aan hoe het eiwit de ontwikkeling van fruitvliegvleugels regelt
- Sinds de beursintroductie heeft Snap Inc. precies gedaan wat het beloofde, dus waarom hebben aandelen het moeilijk?
- Hoe planten suiker gebruiken om wortels te produceren
- Genetische aanwijzingen over hoe honden de beste vrienden van de mens werden
- Babymuizen met een oudere vader huilen anders, kunnen gevolgen hebben voor neurologische ontwikkelingsstoornissen
- Waarom je geen tijgers of andere grote katten moet ontklauwen
- Modellen tonen aan dat koralen beter bestand zijn tegen de opwarming van de oceaan als ze ruilen voor hittebestendige algenvariëteiten
- Nieuw onderzoek helpt de genetische basis te verklaren waarom we er zo uitzien
- Van het laboratorium, de eerste kraakbeen-nabootsende gel die sterk genoeg is voor knieën

- Zwevende druppeltjes stellen wetenschappers in staat om contactloze chemische reacties uit te voeren

- Chemici ontdekken hoe blauw licht blindheid versnelt

- Celcytoskelet als doelwit voor nieuwe actieve middelen

- Onderzoekers kunnen nu eigenschappen van ongeordende polymeren voorspellen
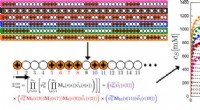
 De ontdekking van Valleytronics zou de grenzen van de wet van Moore kunnen verleggen
De ontdekking van Valleytronics zou de grenzen van de wet van Moore kunnen verleggen Wat is een stabiele isotoop van waterstof en een essentieel onderdeel van de bom?
Wat is een stabiele isotoop van waterstof en een essentieel onderdeel van de bom?  Onderzoekers brengen de dynamiek van eiwitnetwerken tijdens celdeling in kaart
Onderzoekers brengen de dynamiek van eiwitnetwerken tijdens celdeling in kaart  Southampton naar Shanghai met de trein:een zoektocht van onderzoekers naar klimaatverandering om vliegen te vermijden
Southampton naar Shanghai met de trein:een zoektocht van onderzoekers naar klimaatverandering om vliegen te vermijden Waar bevinden zich de intrinsieke speekselklieren?
Waar bevinden zich de intrinsieke speekselklieren?  Bevat de koolwaterstofsoep van Titan een recept voor het leven?
Bevat de koolwaterstofsoep van Titan een recept voor het leven?  Rapport roept op tot alomvattende actie om armoede in Britse stad aan te pakken
Rapport roept op tot alomvattende actie om armoede in Britse stad aan te pakken Groep organismen die het minst op elkaar lijken?
Groep organismen die het minst op elkaar lijken?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

