
Wetenschap
Welk type binding rond een centrale zou resulteren in een trigonaal vlak molecuul-apex?
Bij sp2-hybridisatie worden drie gelijkwaardige hybride orbitalen gevormd door het mengen van één s-orbitaal en twee p-orbitalen. Deze hybride orbitalen vormen drie sigma-bindingen met drie andere atomen, wat resulteert in een trigonale vlakke moleculaire geometrie. De resterende p-orbitaal staat loodrecht op het vlak van de drie sp2-hybride orbitalen en kan deelnemen aan pi-binding.
Voorbeelden van moleculen met een trigonale vlakke moleculaire geometrie zijn boortrifluoride (BF3), koolstofdioxide (CO2) en formaldehyde (H2CO). In deze moleculen is het centrale atoom (respectievelijk boor, koolstof en koolstof) sp2-gehybridiseerd en vormt het drie sigma-bindingen met de omringende atomen.
 Perovskiet-zonnecellen:mogelijke aspecten van hoog rendement ontdekt
Perovskiet-zonnecellen:mogelijke aspecten van hoog rendement ontdekt Wat zijn de drie stappen van een kettingreactie?
Wat zijn de drie stappen van een kettingreactie?  Nieuwe techniek lokaliseert locaties van individuele moleculen in hun cellulaire buurten
Nieuwe techniek lokaliseert locaties van individuele moleculen in hun cellulaire buurten Hoe warmteopname berekenen
Hoe warmteopname berekenen
In het dagelijks leven gebruiken mensen de termen warmte en temperatuur onderling uitwisselbaar. Op het gebied van thermodynamica en fysica, echter, hebben de twee termen heel verschillende betekenissen. Als u wilt bereke
 Uit welke twee elementen bestaat het watermolecuul?
Uit welke twee elementen bestaat het watermolecuul?
 Hoe Caterpillar schrankladers en multi-terrain werken
Hoe Caterpillar schrankladers en multi-terrain werken  Oostenrijkse wetenschappers racen om geheimen van smeltende gletsjers te onthullen
Oostenrijkse wetenschappers racen om geheimen van smeltende gletsjers te onthullen Grote merken slagen er niet in het gebruik van plastic zakjes aan banden te leggen
Grote merken slagen er niet in het gebruik van plastic zakjes aan banden te leggen  Kan de vergissing in het verwoeste majestueuze Kasjmir-meer worden verholpen?
Kan de vergissing in het verwoeste majestueuze Kasjmir-meer worden verholpen?  Genevieve nadert Mexicos Baja als orkaan van categorie 3
Genevieve nadert Mexicos Baja als orkaan van categorie 3
Hoofdlijnen
- Hoe vrouwelijke hyena's de mannetjes gingen domineren
- Waarom verzamelen vrouwelijke grote hamerhaaien zich elke zomer in Frans-Polynesië?
- Waarom papegaaien soms elkaars baby's adopteren (of doden)
- Bergleeuwen uit Zuid-Californië vertonen de eerste reproductieve effecten van inteelt
- Oude kikkers in massagraf stierven door te veel seks, zegt nieuw onderzoek
- Hebben valsspelers een evolutionair voordeel? Vreemdgaande amoeben onthullen de sleutel tot succesvolle samenlevingen
- Saoedi-Arabische rotskunst toont riemen op prehistorische honden
- Waarom zijn de nakomelingen van oudere moeders minder geschikt om lang en voorspoedig te leven?
- Waarom hebben lever- en spiercellen meer mitochondriën dan andere soorten cellen?
- Wereldsnelheidsrecord voor polymeersimulaties meer dan honderdvoudig verbrijzeld

- Biokatalyse:nieuwe methode om katalytisch actieve enzymen aan te drijven

- Statistische gevolgtrekking om de werkwijze van een zeer ervaren kristallograaf na te bootsen
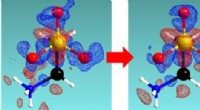
- Kijken hoe moleculen in realtime worden gesplitst
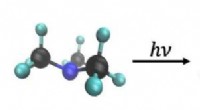
- Nieuwe technologie zet afvalplastic in een uur om in vliegtuigbrandstof

 De gulden middenweg van zwarte gaten vinden
De gulden middenweg van zwarte gaten vinden Hoeveel enzymen zitten er in één cel?
Hoeveel enzymen zitten er in één cel?  Wat draagt de trofeejacht bij aan het behoud van wilde leeuwen?
Wat draagt de trofeejacht bij aan het behoud van wilde leeuwen?  Wetenschappers berekenen hoe koolstofnanobuisjes en hun vezels vermoeidheid ervaren
Wetenschappers berekenen hoe koolstofnanobuisjes en hun vezels vermoeidheid ervaren  Waarom we kin hebben:Onderzoekers beweren dat de kin voortkomt uit evolutie, en niet uit mechanische krachten
Waarom we kin hebben:Onderzoekers beweren dat de kin voortkomt uit evolutie, en niet uit mechanische krachten  Hoeveel mensen morgen? De Verenigde Naties herzien hun prognoses
Hoeveel mensen morgen? De Verenigde Naties herzien hun prognoses WOW Air zoekt schuldsanering nu Icelandair stopt met praten
WOW Air zoekt schuldsanering nu Icelandair stopt met praten Californië werd 30 jaar geleden gewaarschuwd voor klimaatverandering - nu voelt het de effecten
Californië werd 30 jaar geleden gewaarschuwd voor klimaatverandering - nu voelt het de effecten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

