
Wetenschap
Wat zijn de ideale gaswetten?
$$P \propto \frac{1}{V}$$
De wet van Charles: Het volume van een gas is recht evenredig met de temperatuur ervan, wanneer de druk en de hoeveelheid gas constant blijven.
$$V \propto T$$
De wet van Avogadro: Het volume van een gas is recht evenredig met de hoeveelheid gas, wanneer druk en temperatuur constant blijven.
$$V \propto n$$
De wet van Gay-Lussac: De druk van een gas is recht evenredig met de temperatuur ervan, wanneer het volume en de hoeveelheid gas constant blijven.
$$P \propto T$$
Ideale gaswet: Combineert alle bovenstaande wetten en introduceert een evenredigheidsconstante, R, die de universele gasconstante is.
$$PV =nRT$$
Waar:
- P is de druk van het gas
- V is het volume van het gas
- n is de hoeveelheid gas in mol
- R is de universele gasconstante (0,08206 L atm / mol K)
- T is de temperatuur van het gas in Kelvin
 Hoe maak je zilverpoeder?
Hoe maak je zilverpoeder?  Onderzoekers krijgen inzicht in hoe oplosmiddelmoleculen door licht gestuurde reacties beïnvloeden
Onderzoekers krijgen inzicht in hoe oplosmiddelmoleculen door licht gestuurde reacties beïnvloeden Moleculaire twist maakt één katalysator bruikbaar voor drie waterstoftoepassingen
Moleculaire twist maakt één katalysator bruikbaar voor drie waterstoftoepassingen Is H20 een organische of anorganische verbinding?
Is H20 een organische of anorganische verbinding?  Hoe voorkom je dat kalium reageert met zuurstof?
Hoe voorkom je dat kalium reageert met zuurstof?
 Met plastic stro verbod, Washington keert zijn eigen uitvinding de rug toe
Met plastic stro verbod, Washington keert zijn eigen uitvinding de rug toe NASA-satelliet ontdekt windschering die tropische storm Francisco nadelig beïnvloedt
NASA-satelliet ontdekt windschering die tropische storm Francisco nadelig beïnvloedt Welke dieren leven op de pelagische zone?
Welke dieren leven op de pelagische zone?  Wat is het verschil tussen levend en niet-levend wezen?
Wat is het verschil tussen levend en niet-levend wezen?  Controversieel drijvend strand onthuld voor de Franse Rivièra
Controversieel drijvend strand onthuld voor de Franse Rivièra
Hoofdlijnen
- Zeewier bevat veel vitamines en mineralen, maar dat is niet de enige reden waarom westerlingen er meer van zouden moeten eten
- Vrijgen van genetische parasieten kan leiden tot nieuwe verdediging tegen gevaarlijke bacteriën
- Hoe cellen zich ontstekingen herinneren
- Nieuwe biobronnen voor plantaardige peptidehormonen met behulp van technologie voor het bewerken van genen
- Wat zijn de effecten van isolatie in de geest?
- Te ingewikkeld denken? Neuronale activiteit is veel voorspelbaarder dan aangenomen
- Nieuwe aanwijzingen over hoe poortwachter voor de celkern werkt
- Combinatie van warmer water, blootstelling aan chemicaliën versterkt schadelijke effecten bij een kustvis
- Welke elementen bevat glucose?
- Nieuwe alternatieven kunnen de vraag naar schaarse permanente magneten van zeldzame aardmetalen verminderen

- Een nieuwe procedure voor het verkrijgen van een goedkope, ultrahard materiaal dat bestand is tegen radioactiviteit

- Realtime dekking van de binnenkant van de hersenen mogelijk gemaakt
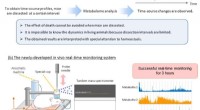
- Een elektrokatalysator voor de reactie van zuurstofontwikkeling bij het splitsen van water
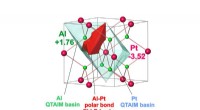
- Elke stap van cycloadditiereacties op het oppervlak visualiseren

 Nieuwe asteroseismische modelleringstool biedt cruciale parameters van een nabij binair systeem
Nieuwe asteroseismische modelleringstool biedt cruciale parameters van een nabij binair systeem Wetenschappers ontdekken hoe 'superbacteriën' E. coli-klonen de menselijke darm overnemen
Wetenschappers ontdekken hoe 'superbacteriën' E. coli-klonen de menselijke darm overnemen  Wat is de wetenschappelijke classificatie van spinazie?
Wat is de wetenschappelijke classificatie van spinazie?  Nieuwe soort stegosaur is het oudste gevonden overal ter wereld
Nieuwe soort stegosaur is het oudste gevonden overal ter wereld Misschien maakt de bankcultuur mensen niet altijd oneerlijk
Misschien maakt de bankcultuur mensen niet altijd oneerlijk Heeft het zonnestelsel de dinosauriërs laten 'stuiteren'?
Heeft het zonnestelsel de dinosauriërs laten 'stuiteren'?  Om kinderarbeid aan te pakken, begin met consumenten
Om kinderarbeid aan te pakken, begin met consumenten De dubbele rand van alomtegenwoordige personalisatie
De dubbele rand van alomtegenwoordige personalisatie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

