
Wetenschap
Wanneer sommige ionische verbindingen oplossen, dissociëren niet al hun bindingen. Wat voor soort geleidbaarheid zou je verwachten dat een dergelijke oplossing zou hebben?
Zwakke elektrolyten zijn verbindingen die slechts gedeeltelijk dissociëren in water. Dit betekent dat sommige ionen van de verbinding vrij kunnen bewegen en elektriciteit kunnen geleiden, terwijl andere aan het molecuul gebonden blijven. Als gevolg hiervan hebben zwakke elektrolyten een lagere geleidbaarheid dan sterke elektrolyten, die volledig dissociëren in water.
De geleidbaarheid van een zwakke elektrolytoplossing hangt af van de concentratie van de oplossing. Bij lage concentraties is de geleidbaarheid laag omdat er minder ionen aanwezig zijn om elektriciteit te geleiden. Naarmate de concentratie toeneemt, neemt ook de geleidbaarheid toe omdat er meer ionen aanwezig zijn. De geleidbaarheid van een zwakke elektrolytoplossing zal echter nooit zo hoog zijn als de geleidbaarheid van een sterke elektrolytoplossing, omdat sommige ionen van de verbinding altijd aan het molecuul gebonden zullen blijven.
Enkele voorbeelden van zwakke elektrolyten zijn azijnzuur, ammoniak en koolzuur.
 Zijn ascorbinezuurtabletten vast bij kamertemperatuur?
Zijn ascorbinezuurtabletten vast bij kamertemperatuur?  Katalysatorstudie bevordert de conversie van kooldioxide naar ethanol
Katalysatorstudie bevordert de conversie van kooldioxide naar ethanol Hoe worden natuurlijke gassen gevormd?
Hoe worden natuurlijke gassen gevormd?  Onderzoekers in West Virginia gebruiken neutronen om materialen te bestuderen voor verbeteringen aan energiecentrales
Onderzoekers in West Virginia gebruiken neutronen om materialen te bestuderen voor verbeteringen aan energiecentrales Wat is de Lewis-structuur van een fluormolecuul (F2)?
Wat is de Lewis-structuur van een fluormolecuul (F2)?
 100 miljoen jaar oude fossielen en zwaartekrachtsgolfwetenschap gebruiken om het toekomstige klimaat op aarde te voorspellen
100 miljoen jaar oude fossielen en zwaartekrachtsgolfwetenschap gebruiken om het toekomstige klimaat op aarde te voorspellen Brazilië zorgt voor toename van wereldwijd bosverlies
Brazilië zorgt voor toename van wereldwijd bosverlies Waarom het water bij de ene overstroming een huis overspoelt, maar het bij de volgende overstroming spaart
Waarom het water bij de ene overstroming een huis overspoelt, maar het bij de volgende overstroming spaart  Het eerste emissievrije onderzoeksstation van Antarctica toont aan dat duurzaam leven overal mogelijk is
Het eerste emissievrije onderzoeksstation van Antarctica toont aan dat duurzaam leven overal mogelijk is NASA houdt tyfoon Noru . in de gaten
NASA houdt tyfoon Noru . in de gaten
Hoofdlijnen
- De voor- en nadelen van klonen
- De centrale hoek vinden
- Is het biosfeerrijk hetzelfde als de voedselketen?
- Nieuwe onderzoeken laten zien hoe de malariaparasiet groeit en ontsnapt uit de rode bloedcellen
- Dikke, puntige – hoe de snavels van albatros zich ontwikkelden om bij hun prooi te passen
- Anatomy & Physiology Project Ideeën
- 10 manieren waarop gegevens werden gebruikt om ziekten te bestrijden
- NASA brengt de video 'Metabolomics:You Are What Eat' uit
- Kudzu-etende kever:goed nieuws of slecht?
- ArtSea Ink:een kleurrijke, Op zeewier gebaseerde inkt voor 3D-printen

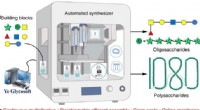
- Geautomatiseerde koolhydraatsynthesizer produceert polysachariden met een recordlengte
- Anionen en kationen in dual-ionbatterijen werken als koeherders- en weversmeisjes

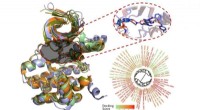
- Computermodellering van WNK-kinaseremmers kan nieuwe hulpmiddelen bieden voor het begrijpen van hypertensie
- 3D-geprinte weefsels kunnen atleten in actie houden

 Netflix vertelt Apple:tel ons uit je streamingplannen
Netflix vertelt Apple:tel ons uit je streamingplannen Archeologie kan ons helpen ons voor te bereiden op toekomstige klimaten - niet alleen terugkijken
Archeologie kan ons helpen ons voor te bereiden op toekomstige klimaten - niet alleen terugkijken Magnonic-apparaten kunnen elektronica zonder veel ruis vervangen
Magnonic-apparaten kunnen elektronica zonder veel ruis vervangen Lijst met kleine insecten
Lijst met kleine insecten Uber-rijders kunnen transittickets kopen in de app voor Denver
Uber-rijders kunnen transittickets kopen in de app voor Denver Lekkage in de Oostzee-pijpleiding schaadt het leven in zee en het klimaat
Lekkage in de Oostzee-pijpleiding schaadt het leven in zee en het klimaat YouTube-opmerkingen onthullen weinig bewijs van politieke echokamers
YouTube-opmerkingen onthullen weinig bewijs van politieke echokamers Australische klimaattool identificeert einde winter in 2050
Australische klimaattool identificeert einde winter in 2050
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

