
Wetenschap
Computermodellering van WNK-kinaseremmers kan nieuwe hulpmiddelen bieden voor het begrijpen van hypertensie
Krediet:North Carolina State University
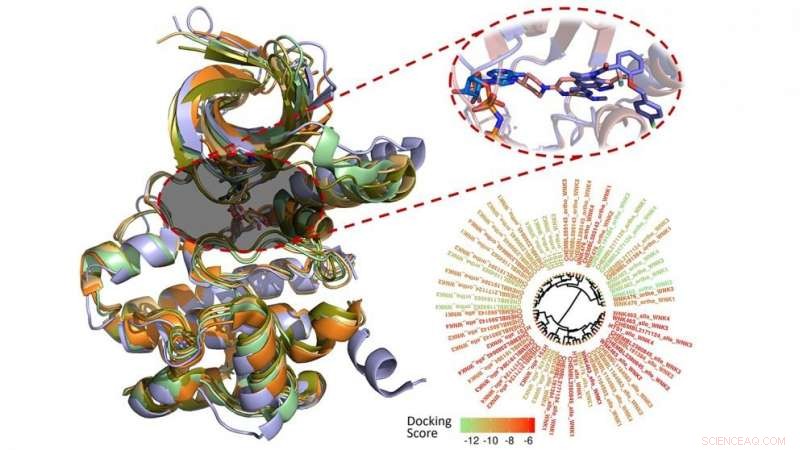
Onderzoekers van de North Carolina State University hebben de bindingsmodi gemodelleerd en geanalyseerd van 210 moleculen waarvan eerder werd gemeld dat ze de functie remmen van een familie van enzymen die betrokken zijn bij het reguleren van zout en bloeddruk in het menselijk lichaam. Hun bevindingen kunnen onderzoekers helpen de complexe relaties tussen zoutregulatie, hypertensie en hoge bloeddruk.
De With-No-Lysine (WNK) familie van enzymen is een groep van vier eiwitten die betrokken zijn bij de bloeddruk en de regulatie van lichaamsvloeistoffen. Deze enzymen zijn in verband gebracht met een zeldzame en ernstige vorm van hypertensie; echter, hun individuele functies worden niet goed begrepen. Om de rol van elk enzym beter te begrijpen, onderzoekers moeten gerichte moleculen ontwikkelen die selectief hun functie kunnen uitschakelen. De moleculen die momenteel in gebruik zijn, binden met alle vier de WNK-eiwitten, voorkomen dat onderzoekers verschillen in functie tussen elk plagen.
Denis Fourches, assistent-professor computationele chemie, en postdoctoraal onderzoeker Melaine Kuenemann gebruikte computermodellering om te karakteriseren, analyseer en visualiseer elk van de 210 moleculen waarvan bekend is dat ze binden aan de WNK-familie.
Fourches en Kuenemann creëerden 3D-modellen van alle 210 verbindingen en plaatsten ze in de bindingsholte van elk WNK-enzym. Vervolgens, ze maten hoe goed de verbindingen daadwerkelijk bonden en analyseerden hun specifieke interacties binnen de vier verschillende bindingsholtes. Ze voerden zelfs real-time moleculaire dynamica-simulaties uit om te bestuderen hoe deze interacties in de loop van de tijd varieerden, nieuwe manieren onthullen om moleculen selectiever te maken voor een specifiek WNK-enzym.
"Er zijn niet zoveel verbindingen waarvan bekend is dat ze de WNK-kinasefamilie remmen, en degene die we hebben binden aan alle vier de enzymen, ', zegt Fourches. 'Als we de verbanden tussen deze eiwitten en hypertensie beter willen begrijpen, we moeten chemicaliën identificeren die één WNK-kinase per keer kunnen afsluiten en zo hun individuele functie beter kunnen ondervragen.
"Dit is de eerste studie die het 'grote plaatje' van deze WNK-remmers probeert te bekijken met behulp van ultramoderne computersimulaties. We hopen dat onze bevindingen medicinale chemici en andere onderzoekers zullen helpen bij het ontwerpen van nieuwe moleculen met een hogere binding potentie en selectiviteit voor elke individuele WNK-kinase."
Het werk verschijnt in Moleculaire Informatica .
 Cholesterol helpt het griepvirus te ontsnappen door het membraan van de gastheercel
Cholesterol helpt het griepvirus te ontsnappen door het membraan van de gastheercel Op palladium gebaseerd metaalglas met hoge trombogene weerstand
Op palladium gebaseerd metaalglas met hoge trombogene weerstand Volledig inkjet-geprinte op vanadiumdioxide gebaseerde radiofrequentieschakelaars voor flexibele herconfigureerbare componenten
Volledig inkjet-geprinte op vanadiumdioxide gebaseerde radiofrequentieschakelaars voor flexibele herconfigureerbare componenten Invriezen en smelten voor Kindergarten
Invriezen en smelten voor Kindergarten De gevoelige spanningssensor die het gewicht van een veer kan detecteren
De gevoelige spanningssensor die het gewicht van een veer kan detecteren
 Van kolen en koeien - het verhogen van de landbouwopbrengsten in Afrika
Van kolen en koeien - het verhogen van de landbouwopbrengsten in Afrika Nieuwe satellietmetingen laten zien hoe vervuild de lucht in Los Angeles werkelijk is
Nieuwe satellietmetingen laten zien hoe vervuild de lucht in Los Angeles werkelijk is Het strandevenement in Bombay toont problemen aan bij het voorspellen van aardbevingen
Het strandevenement in Bombay toont problemen aan bij het voorspellen van aardbevingen 11% van de vernietigde vochtige tropische bossen kan worden hersteld om het klimaat te verbeteren, omgeving
11% van de vernietigde vochtige tropische bossen kan worden hersteld om het klimaat te verbeteren, omgeving Top 10 milieuvriendelijke vervangers voor plastic
Top 10 milieuvriendelijke vervangers voor plastic
Hoofdlijnen
- Haaien evolueerden vliegtuigachtige attributen om in habitats te passen
- Onderzoeker onderzoekt de rol van kleine RNA's in communicatie tussen cellen
- Gist brengt genetische variaties in de schijnwerpers die verband houden met resistentie tegen geneesmiddelen
- Twee eiwitten behouden de pluripotentie van embryonale stamcellen op verschillende manieren
- Hoe verschilt mitose in de cellen van dieren en planten?
- Wat zijn de verschillen tussen een CZS en een PNS?
- Sommige apen die vatbaar zijn voor isolatie
- Hebben mensen en bananen echt 50 procent van hetzelfde DNA?
- Maak kennis met de oudste dierlijke afstamming van Madagascar, een draaimolenkever met een 206 miljoen jaar oude oorsprong
- Groene chemie en biobrandstof:het mechanisme van een sleutelfoto-enzym gedecodeerd

- Onderzoekers turbochargeren waterstofbrandstofcellen met nieuw ionengeleidend copolymeer

- Verschil in eigenschappen van hoofdgroep en overgangsmetalen

- Esdoornbladextract kan huidrimpels in de kiem smoren

- Nieuw isolatiemateriaal zorgt voor een efficiëntere elektriciteitsdistributie

 Wetenschappers verbeteren deep learning-methode voor neurale netwerken
Wetenschappers verbeteren deep learning-methode voor neurale netwerken 10 Gebruik van alfastraling
10 Gebruik van alfastraling Microplastics beïnvloeden sterfte en voortplanting van zandkrabben, studie vondsten
Microplastics beïnvloeden sterfte en voortplanting van zandkrabben, studie vondsten Waarom Amazon, Google en Apple willen je opnemen
Waarom Amazon, Google en Apple willen je opnemen Japan zet zich schrap voor meer regen na overstromingen aardverschuivingen
Japan zet zich schrap voor meer regen na overstromingen aardverschuivingen Het verminderen van zout in Parmigiano Reggiano-kaas heeft mogelijk geen negatieve invloed op de smaak
Het verminderen van zout in Parmigiano Reggiano-kaas heeft mogelijk geen negatieve invloed op de smaak De culturele betekenis van koolstofhoudende veengebieden voor plattelandsgemeenschappen
De culturele betekenis van koolstofhoudende veengebieden voor plattelandsgemeenschappen Tropische cycloon Ava trekt weg uit Madagaskar
Tropische cycloon Ava trekt weg uit Madagaskar
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

