
Wetenschap
Hoeveel elektronen ontvangt een niet-metaal en metaal tijdens een chemische reactie?
Dit zijn de algemene trends:
Metalen: Metalen hebben de neiging elektronen te verliezen tijdens chemische reacties en worden positief geladen ionen die kationen worden genoemd. Dit komt omdat metalen een relatief lage elektronegativiteit hebben, wat betekent dat ze een zwakkere aantrekkingskracht hebben op elektronen. Door elektronen te verliezen bereiken metalen een stabielere elektronenconfiguratie met een volledig extern energieniveau.
Niet-metalen: Niet-metalen daarentegen hebben de neiging om tijdens chemische reacties elektronen op te nemen en negatief geladen ionen te worden die anionen worden genoemd. Dit komt omdat niet-metalen een relatief hoge elektronegativiteit hebben, wat betekent dat ze een sterkere aantrekkingskracht op elektronen hebben. Door elektronen te verwerven, bereiken niet-metalen een stabielere elektronenconfiguratie met een volledig extern energieniveau.
Het specifieke aantal elektronen dat een atoom wint of verliest bij een chemische reactie wordt bepaald door zijn positie op het periodiek systeem. Elementen in dezelfde groep (verticale kolom) hebben doorgaans hetzelfde aantal valentie-elektronen, dit zijn de elektronen op het buitenste energieniveau, en daarom hebben ze de neiging vergelijkbare chemische reacties te ondergaan.
Alkalimetalen in Groep 1 verliezen bijvoorbeeld altijd één elektron, aardalkalimetalen in Groep 2 verliezen altijd twee elektronen en halogenen in Groep 7 krijgen altijd één elektron.
Over het algemeen wordt het aantal gewonnen of verloren elektronen bij een chemische reactie bepaald door het elektronegativiteitsverschil tussen de betrokken atomen. Hoe groter het elektronegativiteitsverschil, hoe waarschijnlijker het is dat de reactie zal resulteren in de vorming van ionen.
 Stabiele toevoer van elektrochroom metallo-supramoleculaire polymeer
Stabiele toevoer van elektrochroom metallo-supramoleculaire polymeer De geur van pure chocolade, gedemystificeerd
De geur van pure chocolade, gedemystificeerd Voedingswetenschappers willen plantaardige eiwitten lekkerder en gezonder maken
Voedingswetenschappers willen plantaardige eiwitten lekkerder en gezonder maken Wetenschappers hebben geanalyseerd hoe een speciale behandeling goedkope metaaloxide-foto-elektroden verbetert
Wetenschappers hebben geanalyseerd hoe een speciale behandeling goedkope metaaloxide-foto-elektroden verbetert Beton wordt sterker en duurzamer met hars
Beton wordt sterker en duurzamer met hars
 Onderzoekers bepalen waarom de oceaan de afgelopen tien jaar meer koolstof heeft opgenomen
Onderzoekers bepalen waarom de oceaan de afgelopen tien jaar meer koolstof heeft opgenomen Uitslag van bosbranden breekt uit in Indonesië
Uitslag van bosbranden breekt uit in Indonesië Voedselresten worden zuivel- en vleesvervangers
Voedselresten worden zuivel- en vleesvervangers NASA's Aqua-satelliet vangt Typhoon Norus 10 mijl breed oog
NASA's Aqua-satelliet vangt Typhoon Norus 10 mijl breed oog Platentektoniek kan de Cambrische explosie hebben veroorzaakt, studie toont
Platentektoniek kan de Cambrische explosie hebben veroorzaakt, studie toont
Hoofdlijnen
- Hoe een besmettelijke kanker zich verspreidde onder mosselen
- Nieuwe drievoudige medicijncombinatie effectief tegen antibioticaresistente bacteriën
- Cyberbiosecurity en bescherming van de biowetenschappen
- Nieuwe tool decodeert complexe genomische gegevens van één cel
- Leven met een moordenaar:hoe een onwaarschijnlijke associatie tussen bidsprinkhaangarnalen en mosselen het biologische principe schendt
- Uitbreiding van Braziliaans suikerriet kan de wereldwijde CO2-uitstoot verminderen
- De evolutionaire oorsprong van de darm
- Onderzoekers ontwikkelen een model om te laten zien hoe bacteriën groeien in sanitaire systemen
- Wat voor soort relatie ontstaat er als een bij bloemen vliegt om nectar te krijgen?
- Een nieuwe methode om ionen door celmembranen te transporteren op basis van een enkel aminozuur
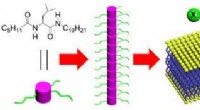
- Onderzoekers vereenvoudigen en stroomlijnen de organische chemische synthese drastisch

- Opsporen van vuilbronnen voor strafrechtelijk onderzoek
- VCU-uitvinders handapparaat brengt enorme verbeteringen aan het watertestproces

- Onderzoekers gebruiken neurale netwerken voor geurherkenning

 Koppelingen en uiteenvallen van autofabrikanten
Koppelingen en uiteenvallen van autofabrikanten Oude culturen hielden ook van hun honden
Oude culturen hielden ook van hun honden  Astronomen detecteren eerste sterren die uit de kosmische middeleeuwen opborrelen
Astronomen detecteren eerste sterren die uit de kosmische middeleeuwen opborrelen Patroonherkenning van chemische golven in de chemische reactie van Belousov-Zhabotinsky
Patroonherkenning van chemische golven in de chemische reactie van Belousov-Zhabotinsky Alexa, kunnen we een echt gesprek hebben?
Alexa, kunnen we een echt gesprek hebben? Nieuwe laser treft markering op kankerbeeldvorming voor luchthavenbeveiliging
Nieuwe laser treft markering op kankerbeeldvorming voor luchthavenbeveiliging Californië staat op het punt wapens meer te gaan belasten als alcohol en tabak – en dat zou een deuk kunnen slaan in wapengeweld
Californië staat op het punt wapens meer te gaan belasten als alcohol en tabak – en dat zou een deuk kunnen slaan in wapengeweld  Mechanische sensoren helpen de celorganisatie te coördineren tijdens oogontwikkeling
Mechanische sensoren helpen de celorganisatie te coördineren tijdens oogontwikkeling
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

