
Wetenschap
Waarom is het kookpunt van H2O hoger dan dat van HF?
H2O heeft een hoger kookpunt (100°C) dan HF (20°C) vanwege de aanwezigheid van sterkere waterstofbruggen in H2O.
- Waterstofbinding is een soort intermoleculaire kracht die optreedt tussen moleculen met een waterstofatoom gebonden aan een zeer elektronegatief atoom, zoals zuurstof of fluor.
- In H2O is het zuurstofatoom zeer elektronegatief, waardoor er een sterke gedeeltelijke positieve lading op de waterstofatomen ontstaat. Hierdoor kunnen de waterstofatomen waterstofbruggen vormen met de alleenstaande elektronenparen op de zuurstofatomen van aangrenzende watermoleculen.
- HF heeft daarentegen een zwakkere waterstofbinding omdat de elektronegativiteit van fluor niet zo sterk is als die van zuurstof. De waterstof-fluorbinding is covalenter en de gedeeltelijke positieve lading op het waterstofatoom is kleiner. Dit resulteert in een zwakkere waterstofbinding tussen HF-moleculen.
De sterkere waterstofbinding in H2O leidt tot een hoger kookpunt omdat er meer energie nodig is om de waterstofbruggen te verbreken en het vloeibare water in damp om te zetten.
 Hoe locatietracking werkt
Hoe locatietracking werkt  Gedeelde e-scooters zijn niet altijd zo groen als andere vervoersmogelijkheden
Gedeelde e-scooters zijn niet altijd zo groen als andere vervoersmogelijkheden Hoe stranden en kustlijnen te redden van rampen op het gebied van klimaatverandering
Hoe stranden en kustlijnen te redden van rampen op het gebied van klimaatverandering  Hoe Creek Erosion
Hoe Creek Erosion Project om gedetailleerde gegevens over microplastics te verzamelen begint met expeditie naar de Stille Oceaan
Project om gedetailleerde gegevens over microplastics te verzamelen begint met expeditie naar de Stille Oceaan
Hoofdlijnen
- Nieuwe beeldanalysemethode voor time-lapse-microscopie laat zien hoe gigantische virussen amoeben infecteren
- Hoe worden lange DNA-strengen in kleine cellen verpakt?
- Als ik honderden Australiërs vroeg of ze insecten zouden eten, zeiden de meesten ja, dus wat houdt mensen tegen?
- Wat zijn korte, haarachtige structuren gemaakt van microtubuli die helpen bij het verplaatsen van cellen?
- Waarom gebruiken je cellen zuurstof?
- Wetenschapper van Harvard zegt dat wij eten en koken
- Bloem trekt insecten aan door zich voor te doen als paddenstoel
- Hoe worden groepen genoemd?
- Wat zijn enkele voor- en nadelen van het gebruik van DNA-analyse om rechtshandhaving bij criminaliteit te bevorderen?
- Gemodificeerd kankermedicijn effectief tegen multiresistente bacteriën
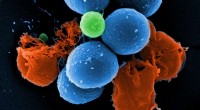
- Onderzoekers zetten belangrijke stap richting gonorroevaccin

- Aan het oppervlak blootgestelde nanodendrieten met hoge index als ORR-elektrokatalysator

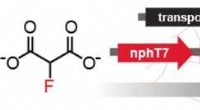
- Fluorbevattende moleculen uit celculturen
- Zelfassemblage in meerdere stappen opent de deur naar nieuwe herconfigureerbare materialen

 Waarom is het niet mogelijk om de driftsnelheid van elektronen te meten door hun reis langs de geleider te timen?
Waarom is het niet mogelijk om de driftsnelheid van elektronen te meten door hun reis langs de geleider te timen?  Hoe magnetische borden op aluminium
Hoe magnetische borden op aluminium Hoe de dichtheid van vloeistoffen te meten
Hoe de dichtheid van vloeistoffen te meten NIST biedt de elektronica-industrie twee manieren om te snuffelen in zelforganiserende moleculen
NIST biedt de elektronica-industrie twee manieren om te snuffelen in zelforganiserende moleculen Universele optothermische micro/nanoschaal rotoren
Universele optothermische micro/nanoschaal rotoren Onderzoekers stellen proof-of-principle vast in supergeleiderstudie
Onderzoekers stellen proof-of-principle vast in supergeleiderstudie Kan Twitter winstgevender worden onder Elon Musk?
Kan Twitter winstgevender worden onder Elon Musk? Hoe OV-bureaus het eigen vermogen kunnen bevorderen
Hoe OV-bureaus het eigen vermogen kunnen bevorderen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

