
Wetenschap
Waarom zouden zoutzuur en natriumhydroxide worden gebruikt bij neutralisatie in plaats van andere zuren en alkaliën?
1. Sterk zuur en base:
HCl is een sterk zuur, terwijl NaOH een sterke base is. Dit betekent dat ze allebei volledig dissociëren in water, waardoor een hoge concentratie H+-ionen (uit HCl) en OH--ionen (uit NaOH) vrijkomt. Deze hoge mate van dissociatie zorgt voor een snelle en volledige neutralisatiereactie.
2. Oplosbaarheid:
Zowel HCl als NaOH zijn zeer oplosbaar in water. Dit betekent dat ze gemakkelijk kunnen worden opgelost om oplossingen met bekende concentraties te vormen. Dit is belangrijk voor nauwkeurige stoichiometrische berekeningen en het bereiken van een nauwkeurig neutralisatiepunt.
3. Kosteneffectiviteit:
HCl en NaOH zijn relatief goedkope en gemakkelijk verkrijgbare chemicaliën. Ze worden vaak gebruikt in verschillende industrieën en laboratoria, waardoor ze gemakkelijk te verkrijgen en te hanteren zijn.
4. Lage toxiciteit:
Vergeleken met andere sterke zuren en alkaliën zijn HCl en NaOH relatief minder giftig. Hoewel ze brandwonden aan de huid en oogirritatie kunnen veroorzaken, kunnen goede veiligheidsmaatregelen deze risico's minimaliseren.
5. Niet-vluchtige aard:
HCl en NaOH zijn niet-vluchtige verbindingen. Dit betekent dat ze niet gemakkelijk verdampen bij kamertemperatuur, in tegenstelling tot sommige andere zuren en basen. Deze eigenschap zorgt voor een betere controle over de reactie en vermindert het risico op dampen en dampemissies.
6. Minimale bijwerkingen:
HCl en NaOH reageren op een eenvoudige en voorspelbare manier en vormen water en een zout (in dit geval NaCl). Er zijn minimale nevenreacties of concurrerende reacties die het neutralisatieproces kunnen verstoren.
Hoewel andere zuren en alkaliën ook kunnen worden gebruikt voor neutralisatiereacties, bieden HCl en NaOH een combinatie van wenselijke eigenschappen, waaronder sterke zuurgraad en basiciteit, hoge oplosbaarheid, kosteneffectiviteit, lage toxiciteit, niet-vluchtigheid en minimale nevenreacties. Deze factoren maken ze tot het meest gebruikte zuur en base voor neutralisatiedoeleinden bij verschillende toepassingen, zoals pH-aanpassingen, zuur-base-titraties en chemische productie.
 Onderzoekers observeren het oplossen van zout op atomair niveau
Onderzoekers observeren het oplossen van zout op atomair niveau  Warmteopslag:wetenschappers ontwikkelen materiaal dat stabiel, efficiënt en milieuvriendelijk is
Warmteopslag:wetenschappers ontwikkelen materiaal dat stabiel, efficiënt en milieuvriendelijk is Onderzoekers ontwikkelen 3D-geprint hout uit zijn eigen natuurlijke componenten
Onderzoekers ontwikkelen 3D-geprint hout uit zijn eigen natuurlijke componenten  Close-ups van korrelgrenzen laten zien hoe zwavelonzuiverheden nikkel bros maken
Close-ups van korrelgrenzen laten zien hoe zwavelonzuiverheden nikkel bros maken  Feiten over neonlichten
Feiten over neonlichten
 Griekenland registreert de warmste winter ooit gemeten:expert
Griekenland registreert de warmste winter ooit gemeten:expert  Vaardigheid en handicap:hoe we ze kunnen herkennen, hoe we het allemaal beter kunnen doen
Vaardigheid en handicap:hoe we ze kunnen herkennen, hoe we het allemaal beter kunnen doen  CO2 uit de lucht halen om de toekomst van kinderen veilig te stellen
CO2 uit de lucht halen om de toekomst van kinderen veilig te stellen Krachtige tyfoonbeslagen Okinawa, karnen naar het vasteland van Japan
Krachtige tyfoonbeslagen Okinawa, karnen naar het vasteland van Japan Verborgen luchtverontreinigende stoffen nemen toe in steden in India en het VK:studie
Verborgen luchtverontreinigende stoffen nemen toe in steden in India en het VK:studie
Hoofdlijnen
- de verbinding die wordt aangetroffen in de buitenste laag van plantencellen, maar NIET in dierlijke cellen?
- Wat is het verschil tussen prokaryotische en eukaryote cellen?
- Hoe bacteriën zwemmen:onderzoekers ontdekken nieuwe mechanismen
- 10 misvattingen over GGO's
- Kussende insecten, vector voor de ziekte van Chagas, voor het eerst met succes gen-editing
- Wat beschrijft het beste hoe chromosomen tijdens mitose naar de polen van de spil bewegen?
- Intracellulaire expressie - waarom transporteiwitmoleculen remmen hebben
- Studie identificeert knelpunten in vroege zeegrasgroei
- Samen sterker:hoe eiwitfilamenten op elkaar inwerken
- Een tweestapsbenadering gebruiken om alifatische amines om te zetten in onnatuurlijke aminozuren
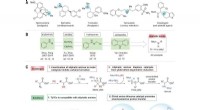
- Supercondensatoren turbogeladen door laxeermiddelen

- Robotbloedhond volgt geuren op de grond

- Bacteriën kunnen een toekomstige bron van elektriciteit zijn
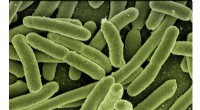
- De prestaties van het apparaat verfijnen met zwermen zwemmende cellen

 Afbeelding:Jupiters wolkenbanden
Afbeelding:Jupiters wolkenbanden Effectief communiceren van tsunami-evacuaties
Effectief communiceren van tsunami-evacuaties Natriumnitraat en zoutzuur
Natriumnitraat en zoutzuur
Natriumnitraat behoort tot de familie van verbindingen die zouten worden genoemd, die worden gevormd door het verenigen van een zuur (in dit geval salpeterzuur) met een base (in dit geval natriumhydroxide). Wanneer natriu
 Het verschil tussen een Black Snake & een Racer
Het verschil tussen een Black Snake & een Racer  Het element dat in elke ORGANISCHE verbinding aanwezig is, is?
Het element dat in elke ORGANISCHE verbinding aanwezig is, is?  'Het heeft pijn gedaan aan mijn portemonnee':hoe een nepnieuwsuitgever het doet na het harde optreden van Facebook
'Het heeft pijn gedaan aan mijn portemonnee':hoe een nepnieuwsuitgever het doet na het harde optreden van Facebook  Toegang krijgen tot scrambling in kwantumsystemen met behulp van matrixproductoperators
Toegang krijgen tot scrambling in kwantumsystemen met behulp van matrixproductoperators Een nieuwe wet om contractfraude en Essay Mills aan te pakken?
Een nieuwe wet om contractfraude en Essay Mills aan te pakken?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

