
Wetenschap
Wat heeft de grotere intermoleculaire kracht water of ethanol?
De intermoleculaire kracht tussen watermoleculen is waterstofbinding, terwijl de intermoleculaire kracht tussen ethanolmoleculen de van der Waals-kracht is. Waterstofbinding is een sterkere intermoleculaire kracht dan de Van der Waals-kracht.
Waterstofbinding vindt plaats wanneer een waterstofatoom in een molecuul is gebonden aan een zeer elektronegatief atoom, zoals zuurstof, stikstof of fluor. Het elektronegatieve atoom trekt de elektronen in de binding naar zichzelf toe, waardoor een gedeeltelijke positieve lading op het waterstofatoom ontstaat. Deze gedeeltelijk positieve lading kan vervolgens de gedeeltelijk negatieve lading op een ander elektronegatief atoom aantrekken, waardoor een waterstofbrug ontstaat.
Van der Waals-krachten zijn zwakkere intermoleculaire krachten die optreden tussen alle moleculen. Van der Waalskrachten worden veroorzaakt door de tijdelijke fluctuaties in de elektronenwolken van moleculen. Door deze fluctuaties ontstaan tijdelijke dipolen, die elkaar vervolgens kunnen aantrekken.
Omdat waterstofbinding een sterkere intermoleculaire kracht is dan de Van der Waals-kracht, hebben watermoleculen een grotere intermoleculaire kracht dan ethanolmoleculen.
 Wat betekent zuurreactie?
Wat betekent zuurreactie?  Wetenschappers stellen nieuwe elektrode voor voor efficiënte kunstmatige synthese van ammoniak
Wetenschappers stellen nieuwe elektrode voor voor efficiënte kunstmatige synthese van ammoniak Science Fair Projects voor Middle School Eighth Grade
Science Fair Projects voor Middle School Eighth Grade Voedingswetenschappers creëren nieuwe magnetische nanodeeltjes voor snelle screening van bestrijdingsmiddelenresiduen in groenten
Voedingswetenschappers creëren nieuwe magnetische nanodeeltjes voor snelle screening van bestrijdingsmiddelenresiduen in groenten Is c2h8 een elektrolyt-propaangas dat wordt gebruikt in barbecuetanks?
Is c2h8 een elektrolyt-propaangas dat wordt gebruikt in barbecuetanks?
 Hittegerelateerde sterfgevallen zullen waarschijnlijk aanzienlijk toenemen naarmate de wereldwijde temperatuur stijgt, waarschuw onderzoekers
Hittegerelateerde sterfgevallen zullen waarschijnlijk aanzienlijk toenemen naarmate de wereldwijde temperatuur stijgt, waarschuw onderzoekers Hoe stadsboeren leren voedsel te verbouwen zonder aarde of natuurlijk licht
Hoe stadsboeren leren voedsel te verbouwen zonder aarde of natuurlijk licht Wat is het verschil tussen satellietbeelden en luchtfotografie?
Wat is het verschil tussen satellietbeelden en luchtfotografie?  Onderzoekers onderzoeken oorzaken van verandering van landbedekking in Afrikaanse savannes
Onderzoekers onderzoeken oorzaken van verandering van landbedekking in Afrikaanse savannes Generatieschuld:hoe leeftijd onze opvattingen over antisociaal gedrag beïnvloedt
Generatieschuld:hoe leeftijd onze opvattingen over antisociaal gedrag beïnvloedt
Hoofdlijnen
- 'Vliegende vaccinator':kunnen genetisch gemanipuleerde muggen een nieuwe strategie tegen malaria bieden?
- Wat maakt een koe een koe? Volledige rundergenoom gesequenced
- Koeltechnologie om de levensvatbaarheid van het gekoelde muizensperma gedurende 10 dagen te behouden
- Cytoplasma: functie en feiten
- Hoe woorden hun betekenis krijgen
- Neanderthaler DNA veranderde de manier waarop moderne mensen eruitzien
- Waarom het laten ontsnappen van zalm gunstig zou kunnen zijn voor beren en vissers
- Studie biedt een model om te voorspellen hoe microbiomen op veranderingen kunnen reageren
- Waarom zijn kalkoenen genetisch gemodificeerd?
- Grote stap in de productie van CO2-neutrale brandstof:zilverdifosfide

- Van batterijafval tot elektrochemische sensor
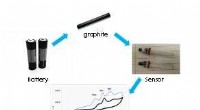
- Wetenschappers ontdekken nieuwe aanwijzing achter ouderdomsziekten en voedselbederf
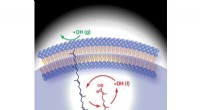
- AFRL bereikt schokkende doorbraak in materiaaltechnologie

- Onderzoekers ontwikkelen op smartphone gebaseerde ovulatietest
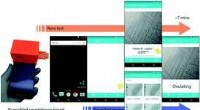
 overstromingen, ruwe zeeën doden 18 in Vietnam als nieuwe storm onderweg
overstromingen, ruwe zeeën doden 18 in Vietnam als nieuwe storm onderweg Kleine precipitaten maken een groot verschil bij het verminderen van de wisselwerking tussen sterkte en ductiliteit
Kleine precipitaten maken een groot verschil bij het verminderen van de wisselwerking tussen sterkte en ductiliteit Een nieuwe familiesuperrechtbank zal misschien geen tijd besparen of leiden tot betere oordelen
Een nieuwe familiesuperrechtbank zal misschien geen tijd besparen of leiden tot betere oordelen De klonen aanvallen:dubbele technieken helpen bij het onthullen van kwaadaardige beeldbewerking
De klonen aanvallen:dubbele technieken helpen bij het onthullen van kwaadaardige beeldbewerking Het geheim achter een kopje koffie of een perfecte pint - een wiskundige
Het geheim achter een kopje koffie of een perfecte pint - een wiskundige NASA kijkt hoe de tropische storm Jose wordt georganiseerd
NASA kijkt hoe de tropische storm Jose wordt georganiseerd Nissan meldt recordwinst voor het hele jaar, maar waarschuwt voor vooruitzichten
Nissan meldt recordwinst voor het hele jaar, maar waarschuwt voor vooruitzichten Hoe naamsverandering de carrière van vrouwelijke onderzoekers kan beïnvloeden
Hoe naamsverandering de carrière van vrouwelijke onderzoekers kan beïnvloeden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

