
Wetenschap
Waarom geleiden verbindingen geen elektriciteit als ze vast zijn, maar kunnen ze wel smelten?
1. Solid State :In een vaste verbinding worden de samenstellende deeltjes (atomen, moleculen of ionen) bij elkaar gehouden door sterke intermoleculaire krachten zoals ionische bindingen, covalente bindingen of waterstofbruggen. Deze krachten creëren een stijve structuur waarin deeltjes op hun positie vastzitten en niet gemakkelijk kunnen bewegen. Als gevolg hiervan zijn er, wanneer een elektrisch veld wordt aangelegd, geen vrije mobiele ionen of elektronen beschikbaar om de elektrische stroom te transporteren, en gedraagt de verbinding zich als een elektrische isolator.
2. Gesmolten staat :Wanneer een verbinding tot het smeltpunt wordt verwarmd, ondergaat deze een faseverandering van een vaste naar een vloeibare toestand. Tijdens het smelten worden de intermoleculaire krachten tussen de deeltjes verzwakt en krijgen de deeltjes voldoende kinetische energie om deze krachten te overwinnen en vrijer te bewegen. Door deze verhoogde mobiliteit kunnen de ionen of elektronen in de verbinding bewegen en reageren op een aangelegd elektrisch veld. Als resultaat wordt de verbinding in gesmolten toestand elektrisch geleidend.
Neem bijvoorbeeld natriumchloride (NaCl) als voorbeeld. In vast NaCl worden de natrium- (Na+) en chloride- (Cl-) ionen bij elkaar gehouden door sterke ionische bindingen, waardoor een stijf kristalrooster ontstaat. In deze toestand geleidt NaCl geen elektriciteit omdat de ionen onbeweeglijk zijn en niet kunnen bewegen om elektrische stroom te transporteren. Wanneer NaCl echter wordt gesmolten, verzwakken de ionische bindingen en kunnen de Na+- en Cl--ionen vrij bewegen. In deze gesmolten toestand kan NaCl elektriciteit geleiden vanwege de mobiliteit van zijn ionen.
Samenvattend komt het verschil in elektrische geleidbaarheid tussen vaste en gesmolten verbindingen voort uit de mobiliteit van hun samenstellende deeltjes. In de vaste toestand beperken sterke intermoleculaire krachten de beweging van de deeltjes, waardoor de elektrische geleiding wordt belemmerd. In de gesmolten toestand zorgen verzwakte intermoleculaire krachten ervoor dat deeltjes vrij kunnen bewegen, waardoor de doorgang van elektrische stroom mogelijk wordt en de verbinding elektrisch geleidend wordt.
 Welke heeft een grotere dichtheid:1 kg platina of 3 kg goud?
Welke heeft een grotere dichtheid:1 kg platina of 3 kg goud?  Lichaamswarmte door flexibele stof kan IoT-apparaten aandrijven voor gezondheidsmonitoring voor mensen, huisdieren, machines
Lichaamswarmte door flexibele stof kan IoT-apparaten aandrijven voor gezondheidsmonitoring voor mensen, huisdieren, machines Cranberry-oligosachariden kunnen urineweginfecties helpen voorkomen
Cranberry-oligosachariden kunnen urineweginfecties helpen voorkomen Hoe PPM & PPB
Hoe PPM & PPB Is methaan oplosbaar in vloeibare stikstof?
Is methaan oplosbaar in vloeibare stikstof?
 De natuurlijke comeback van tropische regenwouden in de savanneregio
De natuurlijke comeback van tropische regenwouden in de savanneregio Nieuwe functionele indicatoren om effecten van menselijke activiteit in tijdelijke rivieren te detecteren
Nieuwe functionele indicatoren om effecten van menselijke activiteit in tijdelijke rivieren te detecteren Satellieten tonen aan dat orkaan Katia niet veel beweegt
Satellieten tonen aan dat orkaan Katia niet veel beweegt Als het noodlot toeslaat, NASA brengt de kracht van de ruimte
Als het noodlot toeslaat, NASA brengt de kracht van de ruimte Spanje verrast en opgetogen door zeldzame sneeuwval
Spanje verrast en opgetogen door zeldzame sneeuwval
Hoofdlijnen
- Biosfeer: definitie, hulpbronnen, cycli, feiten en voorbeelden
- Biologen leren hoe planten hun groeihormoon auxine synthetiseren
- Wat kunnen fruitvliegjes ons leren over hoe wezens voedsel vinden?
- Onderzoekers verduidelijken hoe cellen zichzelf verdedigen tegen virussen
- Wat is een celmembraan?
- Welke laboratoriumtests worden gebruikt om de aanwezigheid van eiwitten te testen?
- Wat viel je op bij het construeren van het DNA-molecuul over de oriëntatie van twee strengen?
- Zombievirussen op een kapingsreis:hoe retrovirale genfragmenten embryonale cellen beïnvloeden
- Kan iemand zich herinneren dat hij geboren is?
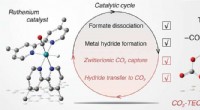
- Monitoring van tussenproducten in CO2-conversie naar formiaat door metaalkatalysator
- Een alternatieve route voor het bestuderen van de intrinsieke eigenschappen van vastestofmaterialen

- Door meniscus ondersteunde techniek produceert perovskiet PV-films met een hoog rendement

- Polymeerfilms slagen voor de elektronenkanontest

- Ontdekking binnen het celcyclusproces om inzicht te krijgen in cellulaire ziekten
 Hoe uw romantische hechtingsstijl uw financiën beïnvloedt, welzijn
Hoe uw romantische hechtingsstijl uw financiën beïnvloedt, welzijn Onderzoekers creëren nanostructuren voor een efficiënte en duurzame afbraak van verontreinigende stoffen
Onderzoekers creëren nanostructuren voor een efficiënte en duurzame afbraak van verontreinigende stoffen  Hoe drijvende bruggen werken
Hoe drijvende bruggen werken  Hoe getekende magnitude in decimaal te converteren
Hoe getekende magnitude in decimaal te converteren  Magnetisme ontmoet topologie op een supergeleideroppervlak
Magnetisme ontmoet topologie op een supergeleideroppervlak Wandelgidsen als brug naar meer duurzaamheid van het toerisme in beschermde gebieden
Wandelgidsen als brug naar meer duurzaamheid van het toerisme in beschermde gebieden Wetenschappers stellen tien sleutelcomponenten voor om klimaatslimme mariene ruimtelijke planning wereldwijd te bevorderen
Wetenschappers stellen tien sleutelcomponenten voor om klimaatslimme mariene ruimtelijke planning wereldwijd te bevorderen  Trollen of criminelen? Groot-Brittannië worstelt met sociale media
Trollen of criminelen? Groot-Brittannië worstelt met sociale media
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

