
Wetenschap
Waarom is CH3Cl polair?
1. Verschil in elektronegativiteit:Elektronegativiteit is de maatstaf voor het vermogen van een atoom om elektronen naar zichzelf toe te trekken. Chloor (Cl) heeft een hogere elektronegativiteit (3,0) dan koolstof (2,5). Dit betekent dat Cl elektronen sterker aantrekt dan C.
2. Polariteit van de binding:Als gevolg van het elektronegativiteitsverschil wordt de covalente binding tussen C en Cl in CH3Cl polair. De elektronen in de C-Cl-binding worden meer naar het Cl-atoom getrokken, waardoor een gedeeltelijke negatieve lading (δ-) op Cl ontstaat en een gedeeltelijke positieve lading (δ+) op C.
3. Moleculaire polariteit:De aanwezigheid van polaire bindingen in een molecuul kan resulteren in moleculaire polariteit. In CH3Cl creëert de polaire C-Cl-binding een algemene moleculaire polariteit. De gedeeltelijke negatieve lading op het Cl-atoom en de gedeeltelijke positieve lading op het C-atoom geven het molecuul een netto dipoolmoment.
4. Dipoolmoment:Het dipoolmoment is een maat voor de polariteit van een molecuul. Het is een vectorgrootheid die de grootte en richting van de ladingsscheiding vertegenwoordigt. Hoe groter het dipoolmoment, hoe polairder het molecuul. CH3Cl heeft een dipoolmoment dat niet nul is vanwege het elektronegativiteitsverschil tussen C en Cl, waardoor het een polair molecuul is.
5. Waterstofbinding:naast de polariteit van de binding kan CH3Cl ook deelnemen aan waterstofbinding, zij het in mindere mate. Het waterstofatoom in de CH3-groep is enigszins positief, wat kan interageren met de gedeeltelijke negatieve lading op het Cl-atoom van een ander CH3Cl-molecuul. Deze waterstofbruggen dragen bij aan de intermoleculaire krachten tussen CH3Cl-moleculen en kunnen de fysische eigenschappen van de stof beïnvloeden.
 Nieuw proces voor het conserveren van hout kan voordelen bieden ten opzichte van drukbehandeling
Nieuw proces voor het conserveren van hout kan voordelen bieden ten opzichte van drukbehandeling Vloeibare kristallen tonen potentieel voor de detectie van neurodegeneratieve ziekten
Vloeibare kristallen tonen potentieel voor de detectie van neurodegeneratieve ziekten  Nieuwe manier om RNA te zien kan ziekteverwekkers helpen bestrijden
Nieuwe manier om RNA te zien kan ziekteverwekkers helpen bestrijden Welke mineraalgroep bevat verbindingen van zuurstof en een metaal?
Welke mineraalgroep bevat verbindingen van zuurstof en een metaal?  Wat is een elektrolytische geleiding?
Wat is een elektrolytische geleiding?
 Gravende zoogdieren graven voor de kost, maar hoe doen ze dat?
Gravende zoogdieren graven voor de kost, maar hoe doen ze dat?  Het ruilen van vlees voor zeevruchten kan de voeding verbeteren en de uitstoot verminderen
Het ruilen van vlees voor zeevruchten kan de voeding verbeteren en de uitstoot verminderen Japanse geologische geschiedenis in kwestie na ontdekking van metamorf gesteente microdiamanten
Japanse geologische geschiedenis in kwestie na ontdekking van metamorf gesteente microdiamanten Karkassen van schildpadden spoelen aan in Sri Lanka na scheepsbrand
Karkassen van schildpadden spoelen aan in Sri Lanka na scheepsbrand Hoe de milieu-impact van een brood verminderen? (Update)
Hoe de milieu-impact van een brood verminderen? (Update)
Hoofdlijnen
- Wat zijn fysieke kenmerken die worden doorgegeven van ouders?
- Paleontologen onthullen nieuwe gegevens over de evolutie van de mensachtige schedel
- Kunnen schimmels plastic vervangen?
- Wat gebeurt er met hun parasieten als gastheren uitsterven?
- Nieuw onderzoek laat zien hoe sommige kippen gestreepte veren kregen
- Onderzoek is baanbrekend in het begrijpen hoe een moleculaire motor kracht genereert
- Uit onderzoek blijkt hoe het ene enzym op het andere meelift om tRNA te herkennen
- Saguaro en andere torenhoge cactussen hebben een roerige geschiedenis
- Geen microben? probleem voor rupsen
- Nieuwe fluoroforen kunnen kanker helpen bestrijden

- Voeg gewoon water toe - scheikundigen ontdekken een mechanisme achter het dopen van organische halfgeleiders

- Nieuwe katalysator zet broeikasgassen om in waterstofgas
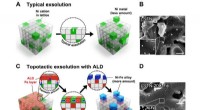
- Keramische membranen scheiden kleine organische moleculen met een molecuulmassa van 200 Dalton

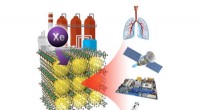
- Xenongas uit afvalstromen halen
 Kan kunstmatige intelligentie nieuwe deuren openen voor het ontdekken van materialen?
Kan kunstmatige intelligentie nieuwe deuren openen voor het ontdekken van materialen? Winst Samsung Electronics daalt naarmate de verkoop van telefoons daalt
Winst Samsung Electronics daalt naarmate de verkoop van telefoons daalt Herbebossing van Europa zou de regenval doen toenemen - nieuw onderzoek
Herbebossing van Europa zou de regenval doen toenemen - nieuw onderzoek NASA-raketmissie die ontsnappende radiogolven bestudeert
NASA-raketmissie die ontsnappende radiogolven bestudeert 's Werelds eerste professionele acrobaten vlogen door het Midden-Oosten 4, 000 jaar geleden
's Werelds eerste professionele acrobaten vlogen door het Midden-Oosten 4, 000 jaar geleden Grootte is belangrijk voor beschermde mariene gebieden die zijn ontworpen om koraal te helpen
Grootte is belangrijk voor beschermde mariene gebieden die zijn ontworpen om koraal te helpen Hoe een MPA naar KN te converteren
Hoe een MPA naar KN te converteren  NASA's Terra Satellite ziet de geboorte van tropische storm Imelda
NASA's Terra Satellite ziet de geboorte van tropische storm Imelda
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

