
Wetenschap
Elk Brønsted Lowry-zuur is ook een Lewis-zuur.?
Hoewel veel Bronsted-Lowry-zuren, zoals HCl of H2SO4, ook voldoen aan de criteria van Lewis-zuren, omdat ze een elektronenpaar kunnen accepteren van een eenzaam elektronenpaar op een basis, zijn er enkele Bronsted-Lowry-zuren die dat niet doen.
Bijvoorbeeld,
HSO4- (waterstofsulfaatanion) fungeert alleen als een Bronsted-Lowry-zuur en doneert een proton om H2SO4 te vormen, maar het kan geen elektronenpaar accepteren en gedraagt zich daarom niet als een Lewis-zuur. Een ander voorbeeld is water (H2O) in zuurdissociatie-evenwicht (autoprotolyse van water)
H2O + H2O ⇌ H3O+ + OH-
In dergelijke gevallen waarin alleen protonenoverdracht plaatsvindt, is de term Bronsted-Lowry-zuren/basen geschikter en zullen niet alle Bronsted-Lowry-zuren een Lewis-zuur zijn.
 Chlorofyl verwijderen uit bladeren
Chlorofyl verwijderen uit bladeren Bewerkt plantaardig toxine bezit anti-tumor eigenschappen
Bewerkt plantaardig toxine bezit anti-tumor eigenschappen Studie onthult geheim 18e-eeuws portret
Studie onthult geheim 18e-eeuws portret Wanneer een theeketel begint te fluiten, is dit dan een fysieke of chemische verandering?
Wanneer een theeketel begint te fluiten, is dit dan een fysieke of chemische verandering?  Neutronenstudie van glaucoommedicijnen biedt aanwijzingen over enzymdoelen voor agressieve kankers
Neutronenstudie van glaucoommedicijnen biedt aanwijzingen over enzymdoelen voor agressieve kankers
 Opgelost:hoe getijden aardbevingen kunnen veroorzaken
Opgelost:hoe getijden aardbevingen kunnen veroorzaken Blootstelling aan frackingchemicaliën en afvalwater stimuleert de ontwikkeling van vetcellen
Blootstelling aan frackingchemicaliën en afvalwater stimuleert de ontwikkeling van vetcellen Wat hebben fossielen te maken met Wegeners-theorie?
Wat hebben fossielen te maken met Wegeners-theorie?  Het offshore boorplan van Trump ligt mogelijk dood in het water maar er zijn betere manieren om te leiden op energie
Het offshore boorplan van Trump ligt mogelijk dood in het water maar er zijn betere manieren om te leiden op energie Kleinschalige goudwinning heeft langdurige giftige vervuiling veroorzaakt, van het Californië van de jaren 1860 tot het moderne Peru
Kleinschalige goudwinning heeft langdurige giftige vervuiling veroorzaakt, van het Californië van de jaren 1860 tot het moderne Peru
Hoofdlijnen
- Hoe bacteriën wondgenezing ondersteunen
- Ontdekking van gewasgenen raakt de wortel van voedselzekerheid
- Wetenschappers beperken, bestuderen Chinook in het herstelde leefgebied van de Snoqualmie-rivier
- Verzadigde bodems kunnen van invloed zijn op de overleving van jonge bomen die zijn geplant om de klimaatverandering aan te pakken
- Voor altijd fido? Zuid-Koreaanse hondenkloonkliniek
- Waarom wetenschappers een ondergronds mysterie willen oplossen over waar microben leven
- Wetenschappers bepalen hoe regenboogforel op de juiste manier kan worden gevoerd
- RNA-bewerkingstool een snelle, gevoelige test voor COVID-19
- Wat is transcriptie en wat zijn de belangrijkste stappen in dit proces?
- Meer zien met PET-scans:verrassend nieuw mechanisme voor bevestiging van chemische tracers ontdekt
- Een nanostructuur van silica met chemo-enzymatische compartimentering

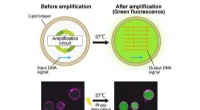
- Nieuwe DNA-amplificatiecapsule belooft veel voor de bestrijding van ziekten
- Onderzoekers pleiten voor beter gebruik van chemische hulpmiddelen om biomedisch onderzoek te verbeteren
- Polymeercoating versnelt de brandstofproductie

 Bezuinigen op iridium
Bezuinigen op iridium Het geheime leven van tanden:Evo-devo modellen van tandontwikkeling
Het geheime leven van tanden:Evo-devo modellen van tandontwikkeling Was de aardbeving van Cascadias 1700 onderdeel van een reeks aardbevingen?
Was de aardbeving van Cascadias 1700 onderdeel van een reeks aardbevingen? Oesterschelpen worden voor topprijzen verkocht terwijl biologen zich inspannen om schelpdierbanken te beschermen
Oesterschelpen worden voor topprijzen verkocht terwijl biologen zich inspannen om schelpdierbanken te beschermen Vulkaan creëert nieuw land nadat lava de oceaanbaai van Hawaï vult
Vulkaan creëert nieuw land nadat lava de oceaanbaai van Hawaï vult Goedkoop, energiezuinige aanpak voor de behandeling van met zware metalen verontreinigd water
Goedkoop, energiezuinige aanpak voor de behandeling van met zware metalen verontreinigd water Nieuw onderzoek laat zien wat er nodig is om de samenleving ten goede te laten veranderen
Nieuw onderzoek laat zien wat er nodig is om de samenleving ten goede te laten veranderen  Grootste simulaties ooit helpen de geschiedenis van de melkweg te ontrafelen
Grootste simulaties ooit helpen de geschiedenis van de melkweg te ontrafelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

