
Wetenschap
Leg uit hoe valentie-elektronen in een atoom worden gebruikt om een volledig buitenste energieniveau te vormen?
1. Stabiele elektronenconfiguratie :Atomen hebben de neiging een stabiele elektronenconfiguratie te bereiken, wat doorgaans de elektronenconfiguratie van een edelgas is. Edelgassen hebben een volledig buitenste energieniveau, waardoor ze chemisch inert zijn.
2. Elektronen delen en binden :Atomen kunnen een volledig buitenste energieniveau bereiken door valentie-elektronen te delen met andere atomen via chemische binding. Door dit proces kunnen atomen elektronen winnen, verliezen of delen om een stabiele configuratie te bereiken.
3. Ionische binding :Bij ionische binding worden een of meer valentie-elektronen van het ene atoom naar het andere overgedragen. Het atoom dat elektronen verliest, wordt positief geladen (kation), terwijl het atoom dat elektronen wint negatief geladen wordt (anion). De elektrostatische aantrekkingskracht tussen tegengesteld geladen ionen houdt de ionische verbinding bij elkaar.
4. Covalente binding :Bij covalente binding delen atomen valentie-elektronen zonder ze volledig over te dragen. Dit delen van elektronen resulteert in de vorming van een covalente binding, wat een sterke chemische binding is. Covalente bindingen worden gevormd wanneer atomen vergelijkbare elektronegativiteiten hebben, wat betekent dat ze een vergelijkbare aantrekkingskracht op elektronen hebben.
5. Metaalbinding :Bij metallische bindingen zijn valentie-elektronen gedelokaliseerd en niet geassocieerd met een bepaald atoom. Deze mobiele valentie-elektronen vormen een "zee" van elektronen die door het metaalrooster stroomt. Deze zee van elektronen is verantwoordelijk voor de karakteristieke eigenschappen van metalen, zoals hoge elektrische en thermische geleidbaarheid, glans en maakbaarheid.
6. Octetregel :De octetregel stelt dat atomen de neiging hebben om elektronen te winnen, te verliezen of te delen om een volledig buitenste energieniveau te bereiken, meestal met acht elektronen (behalve waterstof en helium, die een volledig buitenste energieniveau bereiken met twee elektronen). Deze regel is vooral belangrijk voor het begrijpen van covalente binding.
7. Uitzonderingen :Er zijn enkele uitzonderingen op de octetregel, vooral voor atomen in de derde rij (en daarbuiten) van het periodiek systeem. Deze atomen kunnen soms meer dan acht valentie-elektronen huisvesten op hun buitenste energieniveau.
Door hun valentie-elektronen te gebruiken, kunnen atomen een stabiele elektronenconfiguratie bereiken en chemische bindingen vormen met andere atomen, wat leidt tot de vorming van moleculen en verbindingen met diverse structuren en eigenschappen. Het begrijpen van het gedrag van valentie-elektronen is essentieel voor het begrijpen van de chemische binding en reactiviteit van elementen.
 Waarom het faseveranderingsmateriaal ijzer-tellurium het beste elektriciteit geleidt in zijn ongeordende amorfe fase
Waarom het faseveranderingsmateriaal ijzer-tellurium het beste elektriciteit geleidt in zijn ongeordende amorfe fase  De ultieme voorwaarden om het meeste uit nikkelrijke batterijen te halen
De ultieme voorwaarden om het meeste uit nikkelrijke batterijen te halen Een nieuwe hexamere moleculaire capsule van nanoformaat
Een nieuwe hexamere moleculaire capsule van nanoformaat Wat zijn de twee manieren om enzymactiviteit te remmen?
Wat zijn de twee manieren om enzymactiviteit te remmen?  Afzonderlijke moleculen wegen met licht
Afzonderlijke moleculen wegen met licht
 Voorbereiding op extreme zeespiegel hangt af van locatie, tijd, studie vondsten
Voorbereiding op extreme zeespiegel hangt af van locatie, tijd, studie vondsten Spanje verklaart door brand getroffen regio's tot rampgebieden
Spanje verklaart door brand getroffen regio's tot rampgebieden Eerste Golf-brede onderzoek naar olievervuiling voltooid 10 jaar na Deepwater Horizon
Eerste Golf-brede onderzoek naar olievervuiling voltooid 10 jaar na Deepwater Horizon Milieuactivisten verliezen nieuwe Noorse rechtszaak over Arctische olie
Milieuactivisten verliezen nieuwe Noorse rechtszaak over Arctische olie Hoe marketinglessen ervoor kunnen zorgen dat lelijke producten geen voedselverspilling worden
Hoe marketinglessen ervoor kunnen zorgen dat lelijke producten geen voedselverspilling worden
Hoofdlijnen
- Sahelanthropus, de oudste vertegenwoordiger van de mensheid, was inderdaad tweevoetig
- Hoe stadia van mitose in een cel onder een microscoop te identificeren
- Kunnen honden snel woorden leren?
- Uit langetermijnonderzoek blijkt dat biologische landbouw leidt tot aanpassingen in het genetisch materiaal van planten
- Verschillen tussen kikkersoorten laten zien hoe ontwikkelingspatronen verband houden met diversiteit
- Wat is geheugenverlies precies?
- Hoe is het patriarchaat begonnen? En zal de evolutie daar vanaf komen?
- Wat is anti-biologie?
- Waarom het verkeerd is om veehouderijen de schuld te geven van het coronavirus
- Nieuw onderzoek heeft tot doel de pijnstillende geheimen van dodelijk slakkengif te ontrafelen

- Onderzoek toont aan hoe kleine compartimenten aan cellen vooraf konden gaan

- AI-software helpt bij het ontwerpen van nieuw materiaal voor zonnecellen
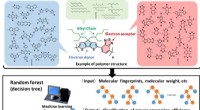
- Wetenschappers breiden mechanisme uit voor het kraken van biochemische code

- Synthetische nanokanalen voor jodidetransport
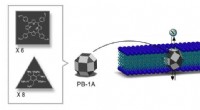
 Waar het begint:jonge hongerige sprinkhanen stapelen zich op in Somalië
Waar het begint:jonge hongerige sprinkhanen stapelen zich op in Somalië Nieuwe weersomstandigheden laten zien hoe het klimaat van Madison in de loop van 40 jaar is veranderd
Nieuwe weersomstandigheden laten zien hoe het klimaat van Madison in de loop van 40 jaar is veranderd Branden alle zuren door dingen heen?
Branden alle zuren door dingen heen?  AI kan ons net zo bedriegen als het menselijk oog bij het zoeken naar buitenaardse wezens
AI kan ons net zo bedriegen als het menselijk oog bij het zoeken naar buitenaardse wezens Rapport toont grote effecten van COVID-19 op de Aziatisch-Amerikaanse beroepsbevolking
Rapport toont grote effecten van COVID-19 op de Aziatisch-Amerikaanse beroepsbevolking Engelennummer 1414:de betekenis en betekenis ervan ontsluiten
Engelennummer 1414:de betekenis en betekenis ervan ontsluiten  Nieuwe studie toont aan dat mensen duizenden jaren geleden natuurlijke kleurstoffen gebruikten om hun kleding te kleuren
Nieuwe studie toont aan dat mensen duizenden jaren geleden natuurlijke kleurstoffen gebruikten om hun kleding te kleuren Onderzoekers krijgen inzicht in eiwitten die cruciaal zijn voor de reproductie van het Zika-virus
Onderzoekers krijgen inzicht in eiwitten die cruciaal zijn voor de reproductie van het Zika-virus
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

