Wetenschap
Wat is de waarde van waterstof?
TL; DR (te lang; niet gelezen)
Waterstof en alle andere elementen in de eerste groep van de periodetabel hebben een valentie van één.
Valence-elektronen
Valence-elektronen zijn de elektronen met het hoogste energieniveau dat beschikbaar is voor chemische binding. In een covalente binding zijn deze valentie-elektronen beschikbaar om te worden gedeeld met een ander atoom om de beschikbare energieniveaus te vullen. Dit buitenste niveau heeft acht potentiële elektronen, maar wanneer alle acht elektronen aanwezig zijn, is de resulterende chemische stof een inert, edel gas. Atomen met minder dan acht elektronen in hun buitenste schil zullen zich binden met andere atomen om genoeg elektronen te delen om acht te maken. Een fluoratoom met zeven valentie-elektronen wil bijvoorbeeld één elektron van een ander atoom delen om acht valentie-elektronen te maken.
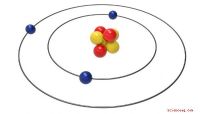
Valence of Hydrogen
Waterstof is een uniek atoom, omdat het slechts twee plekken in zijn buitenste elektronenniveau. Helium heeft twee elektronen en vertoont de eigenschappen van een edelgas. Het valentiegetal van waterstof is één, omdat het slechts één valentie-elektron heeft en slechts één gedeeld elektron nodig heeft om zijn energieniveaus te vullen. Dit betekent dat het met veel elementen kan verbinden. Vier waterstofatomen kunnen bijvoorbeeld binden aan een koolstofatoom, dat vier valentie-elektronen heeft, om methaan te vormen. Evenzo kunnen drie waterstofatomen zich binden met een stikstofatoom, dat vijf valentie-elektronen heeft, om ammoniak te vormen.
Andere waterstofverbindingen
Omdat waterstof een elektron kan delen of een elektron kan verliezen om een volledige of lege buitenste schil, het kan ook ionische bindingen vormen. Waterstof kan zijn enige elektron afgeven aan een chemische stof zoals fluor of chloor die zeven elektronen in hun buitenste schil hebben. Evenzo, omdat waterstof eigenschappen van zowel groep één als groep zeven op het periodiek systeem heeft, kan het zich aan zichzelf binden om waterstofmoleculen te maken. Waterstof kan ook zijn valentie-elektron in oplossing verliezen om een positief waterstofion te maken, wat de zuurgraad in oplossing veroorzaakt.
Valence of Other Atoms
Waterstof en alle andere atomen in groep één van het periodiek systeem (inclusief lithium, natrium en kalium) hebben een valentie van één. Groep twee atomen (inclusief beryllium, magnesium, calcium, strontium en barium) hebben een valentie van twee. Atomen met meer dan twee valentie-elektronen kunnen meer dan één valentie hebben, maar hun maximale valentie is meestal hetzelfde aantal als hun valentie-elektronen.
Groepen drie tot en met 12 (de overgangselementen, inclusief de meeste metalen) hebben verschillende valenties tussen een en zeven. Groep 13-atomen (inclusief boor en aluminium) hebben een maximale valentie van drie. Groep 14-atomen (inclusief koolstof, silicium en germanium) hebben een maximale valentie van vier. Groep 15-atomen (inclusief stikstof, fosfor en arseen) hebben een maximale valentie van vijf. Groep 16-atomen (inclusief zuurstof, zwavel en selenium) hebben een maximale valentie van zes. Groep 17-atomen (inclusief fluor, chloor en broom) hebben een maximale valentie van zeven. Groep 18-atomen, de edelgassen (inclusief neon en argon), hebben acht valentie-elektronen, maar omdat ze deze elektronen bijna nooit delen, zouden ze een valentie van nul hebben.
Hoofdlijnen
- Verschil tussen koppelingstoewijzing en chromosoommapping
- Hier ziet u hoe het einde van de zomertijd u kan beïnvloeden
- Het Mandela-effect:waarom we ons gebeurtenissen herinneren die niet hebben plaatsgevonden
- Mensen evolueren nog steeds - Heres the Evidence
- Hoe permeabiliteit uit te leggen
- Wat is de subeenheid van DNA genaamd?
- Waar vindt ademhaling plaats?
- Bepaling van allelfrequenties
- UFO-psychologie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com