
Wetenschap
Onderzoeksteam ontdekt hoe antibioticaresistente superbacteriën kunnen worden gesaboteerd
Antibioticaresistente ‘superbacteriën’ die de pogingen om ze te doden kunnen dwarsbomen, vormen een urgente volksgezondheidscrisis, en volgens de Centers for Disease Control vinden jaarlijks ruim 2,8 miljoen antibioticaresistente infecties plaats. Onderzoekers over de hele wereld proberen deze uitdaging aan te gaan.
Een samenwerkend team van onderzoekers onder leiding van de Universiteit van Massachusetts Amherst, waaronder wetenschappers van het biofarmaceutische bedrijf Microbiotix, heeft onlangs aangekondigd dat ze met succes hebben geleerd hoe ze een belangrijk onderdeel van de machine kunnen saboteren dat ziekteverwekkers gebruiken om hun gastheercellen te infecteren. de volgende generatie medicijnen identificeren om deze kwetsbare cellulaire machinerie aan te pakken en echte winst te boeken in de volksgezondheid.
De typische strategie bij de behandeling van microbiële infecties is het vernietigen van de ziekteverwekker met een antibioticum, dat werkt door de schadelijke cel binnen te dringen en deze te doden. Dit is niet zo eenvoudig als het klinkt, omdat elk nieuw antibioticum zowel in water oplosbaar moet zijn, zodat het gemakkelijk door de bloedbaan kan reizen, als olieachtig moet zijn om de eerste verdedigingslinie van de pathogene cel, het celmembraan, te kunnen passeren. Water en olie gaan natuurlijk niet samen, en het is moeilijk om een medicijn te ontwerpen dat genoeg van beide kenmerken heeft om effectief te zijn.
De moeilijkheid houdt daar ook niet op, omdat pathogene cellen iets hebben ontwikkeld dat een 'effluxpomp' wordt genoemd, die antibiotica kan herkennen en deze vervolgens veilig uit de cel kan uitscheiden, waar ze geen schade kunnen aanrichten. Als het antibioticum de effluxpomp niet kan overwinnen en de cel kan doden, dan ‘onthoudt’ de ziekteverwekker hoe dat specifieke antibioticum eruit ziet en ontwikkelt hij extra effluxpompen om er efficiënt mee om te gaan – waardoor hij in feite resistent wordt tegen dat specifieke antibioticum.
Eén pad voorwaarts is het vinden van een nieuw antibioticum, of combinaties daarvan, en proberen de superbacteriën een stap voor te blijven.
"Of we kunnen onze strategie veranderen", zegt Alejandro Heuck, universitair hoofddocent biochemie en moleculaire biologie aan UMass Amherst en senior auteur van het artikel. "Ik ben een scheikundige en ik ben altijd erg geïnteresseerd geweest in het begrijpen van hoe chemische moleculen interageren met levende organismen. In het bijzonder heb ik mijn onderzoek gericht op de moleculen die communicatie mogelijk maken tussen een ziekteverwekker en de gastheercel die hij wil bereiken. binnenvallen."
Heuck en zijn collega's zijn vooral geïnteresseerd in een communicatiesysteem dat het Type 3-secretiesysteem wordt genoemd en dat tot nu toe een evolutionaire aanpassing lijkt te zijn die uniek is voor pathogene microben.
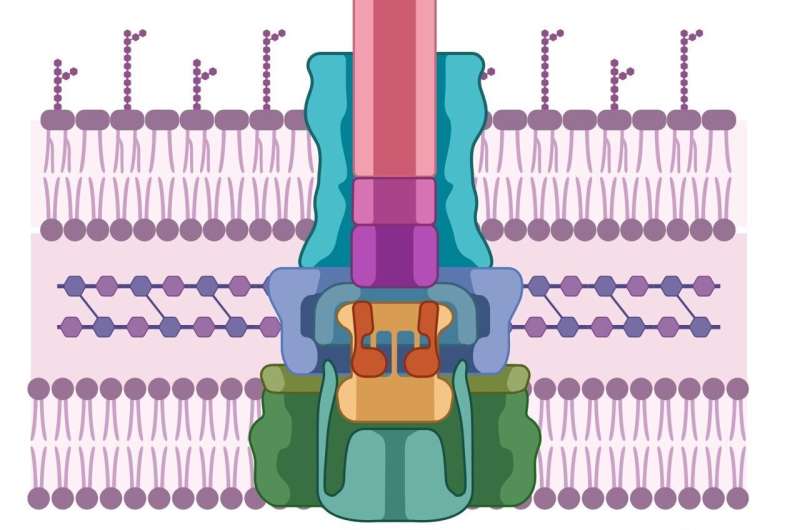
Net als de pathogene cel hebben gastheercellen dikke, moeilijk te penetreren celwanden. Om deze te doorbreken hebben ziekteverwekkers een spuitachtige machine ontwikkeld die eerst twee eiwitten uitscheidt, bekend als PopD en PopB. Noch PopD, noch PopB afzonderlijk kunnen de celwand doorbreken, maar de twee eiwitten kunnen samen een ‘translocon’ creëren – het cellulaire equivalent van een tunnel door het celmembraan. Zodra de tunnel tot stand is gebracht, kan de pathogene cel andere eiwitten injecteren die het werk doen om de gastheer te infecteren.
Dit hele proces wordt het Type 3-secretiesysteem genoemd, en niets ervan werkt zonder zowel PopB als PopD. "Als we de ziekteverwekker niet proberen te doden", zegt Heuck, "dan is er geen kans dat hij resistentie ontwikkelt. We saboteren alleen maar zijn machine. De ziekteverwekker leeft nog; hij is gewoon ineffectief en de gastheer heeft tijd." om zijn natuurlijke afweer te gebruiken om zich te ontdoen van de ziekteverwekker."
De vraag is dus:hoe vind je het molecuul dat de assemblage van de translocon kan blokkeren?
Soms komen er oplossingen voor wetenschappers op die ‘gloeilampmomenten’ waarop plotseling alles logisch is. In dit geval was het meer een bliksemmoment.
Heuck en zijn collega's realiseerden zich dat een enzymklasse genaamd de luciferasen – vergelijkbaar met de enzymen die ervoor zorgen dat blikseminsecten 's nachts gloeien – als tracer kon worden gebruikt. Ze splitsten het enzym in twee helften. De ene helft ging naar de PopD/PopB-eiwitten en de andere helft werd in een gastheercel ingebouwd.
Deze gemanipuleerde eiwitten en gastheren kunnen worden overspoeld met verschillende chemische verbindingen. Als de gastheercel plotseling oplicht, betekent dit dat PopD/PopB met succes de celwand heeft doorbroken, waardoor de twee helften van het luciferase zijn herenigd, waardoor ze gaan gloeien. Maar als de cellen donker blijven? "Dan weten we welke moleculen het translocon breken", zegt Heuck.
Heuck wijst er snel op dat het onderzoek van zijn team niet alleen voor de hand liggende toepassingen heeft in de wereld van de farmaceutische industrie en de volksgezondheid, maar dat het ook ons begrip vergroot van hoe microben precies gezonde cellen infecteren. "We wilden bestuderen hoe ziekteverwekkers werkten", zegt hij, "en toen ontdekten we plotseling dat onze bevindingen een probleem voor de volksgezondheid kunnen helpen oplossen."
Dit onderzoek is gepubliceerd in het tijdschrift ACS Infectious Diseases .
Meer informatie: Hanling Guo et al., Celgebaseerde test om de Translocon-assemblage van type 3-secretiesysteem in Pseudomonas aeruginosa te bepalen met behulp van gesplitste luciferase, ACS-infectieziekten (2023). DOI:10.1021/acsinfecdis.3c00482
Journaalinformatie: ACS-infectieziekten
Aangeboden door Universiteit van Massachusetts Amherst
 Nieuwe multidisciplinaire benadering voor het identificeren van complexe moleculaire adsorbaten
Nieuwe multidisciplinaire benadering voor het identificeren van complexe moleculaire adsorbaten Een nieuwe manier om opeenvolgingen van chemische reacties te automatiseren
Een nieuwe manier om opeenvolgingen van chemische reacties te automatiseren Het gebruik van producentengas
Het gebruik van producentengas  Chemici synthetiseren elektroden voor accu's uit koffiedik
Chemici synthetiseren elektroden voor accu's uit koffiedik Toekomstige opties voor het opslaan van koolstofdioxide:Synthese van anorganische heteroalkenen
Toekomstige opties voor het opslaan van koolstofdioxide:Synthese van anorganische heteroalkenen
 Wat deden oude Egyptische boeren terwijl de Nijl onder water stond?
Wat deden oude Egyptische boeren terwijl de Nijl onder water stond?  Luchtvervuiling door olie- en gasproductielocaties zichtbaar vanuit de ruimte
Luchtvervuiling door olie- en gasproductielocaties zichtbaar vanuit de ruimte NASA's Aqua-satelliet volgt Typhoon Nesat op weg naar Taiwan
NASA's Aqua-satelliet volgt Typhoon Nesat op weg naar Taiwan Het meest ambitieuze project van de natie om kernwapenafval op te ruimen is tot stilstand gekomen
Het meest ambitieuze project van de natie om kernwapenafval op te ruimen is tot stilstand gekomen Verbeterd beheer van gekweekte veengebieden kan 500 miljoen ton koolstofdioxide verminderen
Verbeterd beheer van gekweekte veengebieden kan 500 miljoen ton koolstofdioxide verminderen
Hoofdlijnen
- Er is een microklimaat nodig om een pinyonboom te laten groeien
- Zwarte geit gaat weer gedijen in Israël
- Onthulling van cruciale virulente milRNA's die betrokken zijn bij de initiële infectie van Fusarium oxysporum f. sp. kubusvormig
- Britse rundvleesboeren willen overstappen naar netto nul, maar praktische en financiële belemmeringen staan in de weg
- Controversiële onkruidverdelger houdt EU in de knoop (Update)
- Hoe natuurbeschermers Merri Creek in Melbourne terugbrachten van vervuiling, verwaarlozing en onkruid
- Bacteriën levenscyclus
- Hoge genetische diversiteit ontdekt bij Zuid-Afrikaanse luipaarden
- Coronavirusvorming is succesvol gemodelleerd
- Eenstapskatalysator zet nitraten om in water en lucht

- Computationeel onderzoek beschrijft het activeringsmechanisme van p38-alpha

- Nanomaterialen - korte polymeren, grote impact

- Studie innoveert in glutenvrije formuleringen, smakelijker en voedzamer brood creëren

- Nieuwe techniek waarbij medicijnen bacteriën laten gloeien, kan antibioticaresistentie helpen bestrijden
 DNAzymes en gouden nanodeeltjes:een colorimetrische test voor diagnostiek in het veld
DNAzymes en gouden nanodeeltjes:een colorimetrische test voor diagnostiek in het veld Op boraat gebaseerde passiveringslagen maken omkeerbare calciumbatterijen mogelijk
Op boraat gebaseerde passiveringslagen maken omkeerbare calciumbatterijen mogelijk Beoordeling van evaluaties van Project Safe Neighborhoods-programma's identificeert hiaten in de literatuur, over het algemeen gunstige resultaten
Beoordeling van evaluaties van Project Safe Neighborhoods-programma's identificeert hiaten in de literatuur, over het algemeen gunstige resultaten Supermensen creëren door middel van genmanipulatie en meer
Supermensen creëren door middel van genmanipulatie en meer  Hubble ziet twee overlappende sterrenstelsels
Hubble ziet twee overlappende sterrenstelsels Marketeers kunnen feature creep beheersen, zodat consumenten zich minder geïntimideerd voelen door te veel functies in een product
Marketeers kunnen feature creep beheersen, zodat consumenten zich minder geïntimideerd voelen door te veel functies in een product  Onderzoekers demonstreren teleportatie met behulp van on-demand fotonen van kwantumstippen
Onderzoekers demonstreren teleportatie met behulp van on-demand fotonen van kwantumstippen Marriott zegt dat nieuwe datalek 5,2 miljoen gasten treft
Marriott zegt dat nieuwe datalek 5,2 miljoen gasten treft
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

