
Wetenschap
Nieuwe computationele strategie vergroot het vermogen van medicijnontwerpers om eiwitten in het membraan te targeten
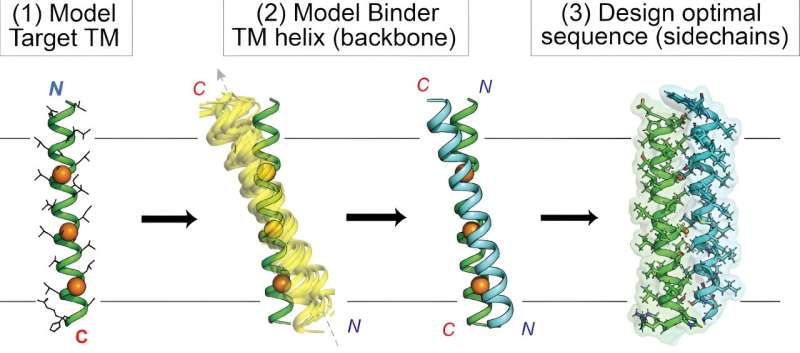
Het raken van doelwitten ingebed in het celmembraan is lange tijd moeilijk geweest voor medicijnontwikkelaars vanwege de uitdagende biochemische eigenschappen van het membraan. Nu hebben scheikundigen van Scripps Research nieuwe, op maat ontworpen eiwitten gedemonstreerd die deze ‘intramembraan’-doelen efficiënt kunnen bereiken.
In hun studie, "De Novo Transmembrane Proteins Designed to Bind and Inhibit a Cytokine Receptor", gepubliceerd in Nature Chemical Biology gebruikten de onderzoekers een unieke computergebaseerde aanpak om nieuwe eiwitten te ontwerpen die zich richten op het membraanomspannende gebied van de erytropoëtine (EPO)-receptor, die de productie van rode bloedcellen regelt en bij kanker mis kan gaan. Naast deze nieuwe EPO-gerichte moleculen leverde het onderzoek een algemeen computerproces op, of 'workflow', voor het stroomlijnen van het flexibele aangepaste ontwerp van eiwitten gericht op intramembraandoelen.
De onderzoekers gebruiken hun aanpak nu om potentiële nieuwe intramembraangerichte behandelingen voor een breed scala aan ziekten te ontwikkelen.
"Dit werk opent veel nieuwe mogelijkheden voor de modulatie van doelen binnen het celmembraan, inclusief voor therapeutische toepassingen en het begrijpen van signaalmechanismen in de celbiologie", zegt co-corresponderend auteur Marco Mravic, Ph.D., een assistent-professor in de celbiologie. Afdeling Integratieve Structurele en Computationele Biologie bij Scripps Research.
De andere co-corresponderende auteurs van de studie waren Daniel DiMaio, MD, Ph.D., van de Yale School of Medicine; en William DeGrado, Ph.D., van de University of California, San Francisco School of Pharmacy, waar Mravic eerder een Ph.D. leerling.
"Een belangrijk doel van de synthetische biologie is het ontwerpen van eiwitten met biologische activiteit. Hier rapporteren we het ontwerp en het testen van een klein eiwit dat specifiek de activiteit verstoort van een veel grotere eiwitreceptor die betrokken is bij de groei en differentiatie van bloedcellen", zegt DiMaio. die hoogleraar genetica en moleculaire biofysica en biochemie is, en adjunct-directeur van het Yale Cancer Center.
"We hebben dit bereikt door ons te richten op het segment van de receptor dat het celmembraan passeert. Omdat veel celeiwitten structureel geconserveerde membraan-overspannende segmenten bevatten, kan deze algemene aanpak toepasbaar zijn op veel andere eiwitdoelen en biedt het een nieuw hulpmiddel om het gedrag van cellen."
Het bereiken van intramembraandoelen is lange tijd een belangrijk doel geweest in de biogeneeskunde, omdat veel eiwitten in cellen – vooral receptoreiwitten – functioneel belangrijke domeinen binnen het membraan hebben. Dergelijke eiwitten spelen een prominente rol op bijna elk gebied van gezondheid en ziekte.
Toch zijn intramembraandoelen geen gewone doelen. Celmembranen zijn over het algemeen gemaakt van twee lagen dicht bij elkaar gelegen, vetgerelateerde ‘lipide’-moleculen, die waterafstotend zijn en andere unieke en complexe eigenschappen hebben. Dit maakt de intramembraanruimte een veel moeilijker doelwit voor medicijnontwerpers, vergeleken met de waterige zones van celoppervlakken of binnenkanten.
"Er zijn zeer weinig succesvolle voorbeelden geweest van medicijnen die zich op deze ruimte in het membraan richten", zegt Mravic.
Die paar successen, waaronder behandelingen voor aandoeningen met een laag aantal bloedplaatjes en cystische fibrose, zijn afkomstig van blinde screenings van grote bibliotheken van verbindingen of van een nauwkeurige nabootsing van eiwitten waarvan bekend is dat ze interageren met partnereiwitten in het celmembraan.
Daarentegen probeerden Mravic en collega's volledig nieuwe eiwitten te ontwerpen – kleine eiwitten die peptiden worden genoemd – om op nieuwe en diverse manieren intramembraaneiwitdoelen te bereiken. Om dat te doen, moesten ze de grens van computationele methoden verleggen, door ‘datamining’ van bekende eiwit-tot-eiwit-interacties in membranen te combineren met traditionele, op natuurkunde gebaseerde voorspellingen van eiwit-interacties.
Uiteindelijk ontwierpen Mravic en zijn collega's de eerste eiwitten die het membraanoverspannende deel van de EPO-receptor op een nieuwe manier binden – die in de natuur niet voorkomt. Het team toonde aan dat deze eiwitten de functie van de receptor zeer specifiek en krachtig blokkeren, in tegenstelling tot eerdere benaderingen.
De resultaten kunnen van zeer direct belang zijn voor onderzoekers die op zoek zijn naar nieuwe manieren om de EPO-receptor te remmen, die vaak abnormaal wordt geactiveerd door tumorcellen om hun groei en overleving te behouden. Maar voor Mravic en zijn collega's vertegenwoordigt de studie vooral een proof-of-principle van een nieuwe en flexibelere benadering van intramembrane targeting.
"We zijn van plan deze aanpak te gebruiken om membraaneiwitten te richten op meerdere biologische processen en ziektegebieden, waaronder kanker, immuunstoornissen en pijn", zegt Mravic.
Hij verwacht ook dat de computationele workflow die hij voor het project heeft ontworpen een algemene versneller zal zijn van het ontwerpen van membraangerichte geneesmiddelen.
"Voorheen bestond het proces eigenlijk uit twee mensen in een donkere kamer die naar een computerscherm keken en zeiden:'Ja, ik denk dat dit er beter uitziet dan dat'", zegt Mravic. "Nu hebben we een groot deel van dat molecuulontwerpproces en de besluitvorming in de computer geautomatiseerd. Omdat we modulair, flexibeler en gestroomlijnder zijn, is de methode toegankelijker voor een breder scala aan wetenschappers."
Mravic en zijn collega's hebben hun computerhulpmiddelen voor openbaar gebruik op Github geplaatst.