
Wetenschap
Snelle vouwing voor synthetische peptiden en microproteïnen
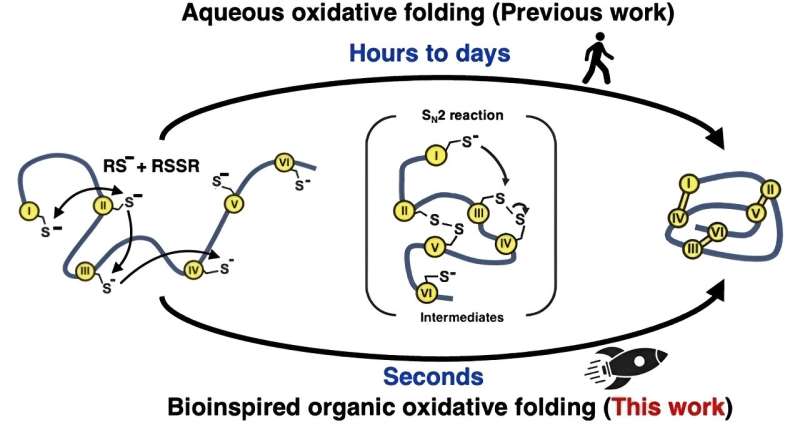
Bepaalde soorten peptiden en microproteïnen voor onderzoek naar geneesmiddelen kunnen efficiënter en sneller worden gemaakt met behulp van een reactieoplosmiddel dat de manier van de natuur helpt nabootsen.
Chemici kunnen nu een belangrijke klasse van kleine eiwitten, cysteïnerijke peptiden genaamd, in hun natuurlijk gevouwen 3D-structuur betrouwbaarder en veel sneller produceren, dankzij methoden die nabootsen wat er in cellen gebeurt. De vooruitgang, geboekt door onderzoekers van Xi'an Jiaotong-Liverpool University (XJTLU) in China en Nanyang Technological University (NTU) in Singapore, is gepubliceerd in het tijdschrift Angewandte Chemie .
Cysteïne is een van de vele verschillende aminozuurmoleculen die aan elkaar kunnen worden gekoppeld om eiwitketens te vormen. Peptiden zijn ketens die korter zijn dan veel natuurlijke eiwitten. Cysteïnemoleculen bevatten elk een zwavelatoom dat zich kan binden aan de zwavel van een ander cysteïne elders in een eiwit, waardoor verschillende delen van de keten bij elkaar worden gehouden.
"Het opnieuw creëren van de 3D-vormen van cysteïnerijke peptiden is altijd een groot probleem geweest bij de productie ervan", zegt Dr. Shining Loo van het XJTLU-team. Veel bioactieve eiwitten en peptiden hebben meerdere disulfidebindingen tussen cysteïne-aminozuren, die cruciaal zijn voor het behouden van hun precieze 3D-gevouwen structuur. Geneesmiddelen zoals linaclotide voor constipatie en ziconotide voor chronische pijn zijn voorbeelden van cysteïnerijke peptidegeneesmiddelen op de markt.
"Onze procedure zou nieuwe mogelijkheden moeten ontsluiten voor de ontdekking van geneesmiddelen en de kosteneffectieve productie van cysteïnerijke microproteïnen en peptiden als therapeutische middelen", voegt onderzoeker Dr. Antony Kam van het XJTLU-team toe.
De invloed van de natuur
Geïnspireerd door hoe de natuur eiwitten snel in cellen vouwt, probeerden de onderzoekers een andere aanpak voor de 'oxidatieve' vouwreacties die de disulfidebindingen vormen. In plaats van op water gebaseerde (waterige) oplossingen te gebruiken, gebruikten ze een mengsel van organische oplosmiddelen. Deze methode imiteert het natuurlijke enzym dat de vorming van disulfidebindingen bemiddelt, door een zeer reactieve omgeving te creëren die de vorming en herschikking van deze bindingen enorm versnelt.
Door op deze manier van de natuur te leren, kon het team 15 verschillende peptiden en microproteïnen maken, tussen 14 en 58 aminozuren lang, met twee tot vijf disulfidebindingen, met snelheden die meer dan 100.000 keer sneller waren dan mogelijk was met waterige oplosmiddelen.
"Het vouwen werd efficiënt binnen één seconde voltooid", merkt Dr. Loo op, "En de reeks microproteïnen die we produceerden toont aan dat onze methode in toekomstig onderzoek effectief zou moeten zijn met een veel groter bereik aan peptiden en microproteïnen."
Deze ontdekking is de nieuwste vooruitgang van de XPad (XJTLU Peptide and Drug) onderzoeksgroep, gezamenlijk opgericht door Dr. Loo en Dr. Kam. Deze groep zet zich in voor het gebruik van hulpmiddelen uit de chemische biologie, synthetische biologie en moleculaire farmacologie om de toepassing van peptiden voor de ontwikkeling van therapeutische middelen te bevorderen.
"De toekomst van het peptideonderzoek is veelbelovend, en we zijn vastbesloten om nog waardevollere vooruitgang op dit gebied te realiseren", besluit Dr. Kam.