
Wetenschap
De enzymen achter celcommunicatie en tumorgroei leren kennen
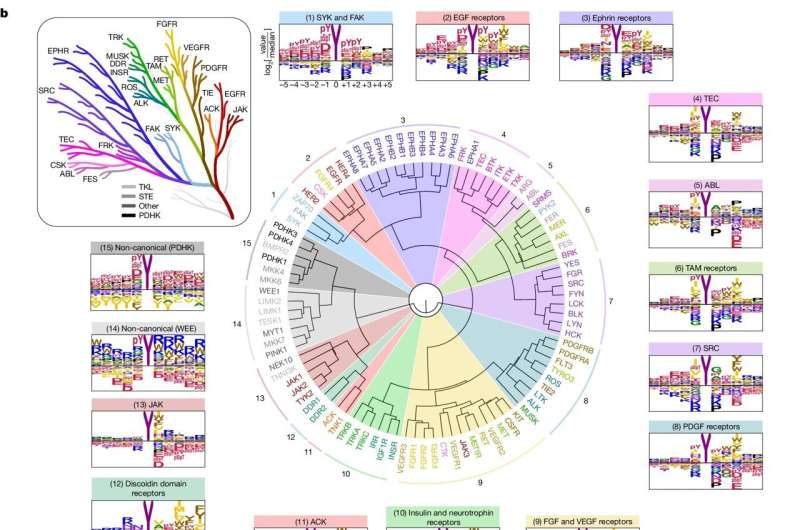
In het menselijk lichaam verspreiden moleculen die bekend staan als kinasen signalen binnen en tussen cellen, waardoor signalen worden doorgegeven waardoor cellen kunnen reageren op veranderingen in de omgeving. Er zijn echter honderden verschillende kinasen in het lichaam, en het identificeren van hun individuele en collectieve functies is een uitdaging.
In een nieuwe studie ontwikkelden Yale-farmacoloog Benjamin Turk en zijn collega's hulpmiddelen waarmee onderzoekers de rol van individuele kinasen kunnen aanscherpen en een completer beeld kunnen krijgen van hun collectieve bijdrage aan de biologische functie.
En omdat disfunctionele kinasen vaak betrokken zijn bij kanker, kan een verfijnder begrip van hun functie in de toekomst betere behandelingen opleveren, zeggen ze.
De bevindingen zijn gepubliceerd in Nature .
Kinasen zijn enzymen die een proces faciliteren dat fosforylatie wordt genoemd. In gevallen waarbij eiwitten betrokken zijn, recruteert een proteïnekinase een stukje van een molecuul dat een fosfaatgroep wordt genoemd (een moleculair fragment dat bestaat uit een fosforatoom en vier zuurstofatomen) en helpt dit te hechten aan een specifiek gebied van een eiwit dat bekend staat als een fosforylatieplaats. Dit kan de functie van het eiwit op een aantal manieren veranderen, bijvoorbeeld door de activiteit ervan te veranderen of waar het zich naartoe verplaatst.
Er zijn twee soorten proteïnekinasen, afhankelijk van de eiwitten die ze fosforyleren:serine/threoninekinasen, waarop Turk zich in een eerder onderzoek concentreerde, en tyrosinekinasen, het onderwerp van het nieuwe onderzoek.
"Vooral tyrosinekinasen zijn erg belangrijk voor de communicatie tussen cellen en organen", zegt Turk, universitair hoofddocent farmacologie aan de Yale School of Medicine. "De belangrijkste klasse van tyrosinekinasen wordt geassocieerd met groeifactoren. Begrijpen hoe tyrosinekinasen signalen doorgeven, is de sleutel tot het begrijpen hoe cellen met elkaar communiceren, waarbij die communicatie vaak een signaal is om te groeien of te delen."
Alle soorten tyrosinekinasen (waarvan er 78 bij mensen voorkomen) hebben de neiging om groeisignalen te oversturen wanneer ze hyperactief worden, wat een sleutelgebeurtenis is bij de tumorgroei, zegt Turk.
"Dit soort onderzoek helpt ons de organisatie van tyrosinekinasesignalering te begrijpen, wat ons inzicht geeft in hoe kinasen groeisignalen uitzenden en hoe het blokkeren van kinasen tot een therapeutische reactie zou kunnen leiden," zei hij.
Voor het onderzoek keken de onderzoekers eerst naar hoe kinasen hun doelwitten herkennen. Eiwitten bestaan uit aminozuren, waarvan er 20 zijn; kinasen herkennen korte reeksen aminozuren die de plaats omringen die ze fosforyleren.
Concreet verdeelden de onderzoekers elk van de 78 tyrosinekinasen in individuele putjes van laboratoriumplaten, mengden ze met een groot aantal verschillende aminozuurreeksen en keken vervolgens naar welke reeksen de kinasen het liefst fosforyleerden. Vervolgens vergeleken ze de voorkeursreeksen van de kinasen met eiwitten in het menselijk lichaam.
"En we hebben hierdoor een paar dingen geleerd", zei Turk.
Ten eerste zouden ze tot op zekere hoogte kinasen kunnen matchen met hun doelwitten in het lichaam, waardoor onderzoekers informatie krijgen over de specifieke rol van een bepaalde kinase.
Misschien nog belangrijker was dat hun bevindingen hen in staat stelden enkele van de bredere regels van tyrosinekinase-activiteit te ontdekken. Het was alsof ze de bedrading van een huis gingen zien in plaats van alleen waar individuele stopcontacten waren, zei Turk.
Eén van die regels heeft te maken met de manier waarop tyrosinekinasen extra kinasen recruteren om een signaalcascade te propageren. Een ander voorbeeld betreft hoe aminozuren rond een fosforyleringsplaats niet alleen bepalen waar fosforylering zal plaatsvinden, maar ook de snelheid waarmee dit plaatsvindt.
En, wat belangrijk is voor de ontwikkeling van behandelingen, stellen de in dit onderzoek ontwikkelde hulpmiddelen de onderzoekers in staat af te leiden welke kinasen op een bepaald moment actief kunnen zijn in een cel of weefsel en hoe verstoringen daarvan hun functie kunnen beïnvloeden.
"We kunnen medicijnen gebruiken om individuele kinasen te remmen, en als we dat doen, kunnen we de activiteit van dat kinase zien afnemen", zei Turk. "En tyrosinekinaseremmers zijn een van de belangrijkste gerichte kankerbehandelingen. Maar kankercellen kunnen zich aanpassen aan dat soort therapie en er resistent tegen worden, waardoor patiënten terugvallen."
Met hun hulpmiddelen kunnen de onderzoekers observeren hoe het blokkeren van één kinase met een remmer er soms toe leidt dat andere kinasen overactief worden, wat zou kunnen verklaren hoe kankercellen zich aanpassen en blijven groeien. En dat kan onderzoekers helpen effectievere therapieën te ontwikkelen, aldus Turk.
In de toekomst wil Turk de regels die in dit werk aan het licht zijn gekomen, gebruiken om belangrijke biologische processen uit elkaar te halen en verder te onderzoeken hoe verschillende cellen reageren op verschillende kinaseremmers.
Maar er is nog een ander belangrijk voordeel van dit werk voor hem.
Tyrosinekinasen zijn evolutionair gesproken nieuwer dan andere kinasen en komen voor bij meercellige organismen. Toen Turk en zijn collega's menselijke tyrosinekinasen vergeleken met die in nematoden – een soort worm waarvan de menselijke tak van de evolutionaire boom miljoenen jaren geleden afweek – de specificiteit van beide groepen kinasen, of hoe specifiek ze zijn over hun doelwitten, waren zeer vergelijkbaar.
"Dat zegt dat deze specificiteit – en het begrijpen hoe het ontstaat – er echt toe doet", zei Turk. "Het is gedurende miljoenen jaren van evolutie bewaard gebleven, en de natuur zou het zonder reden niet zo gedetailleerd hebben onderhouden."