
Wetenschap
Hoe gelijke ladingen in enzymen biochemische reacties regelen
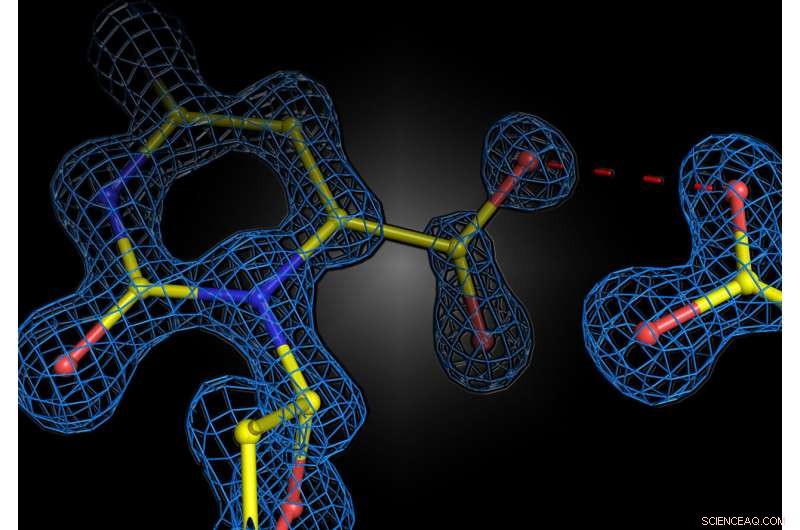
Structurele momentopname van de enzymreactie in het menselijke enzym orotidine 5'-fosfaatdecarboxylase. De twee negatieve ladingen van het substraat en het enzym stoten elkaar niet af, maar vormen een aantrekkelijke interactie. Krediet:Kai Tittmann
Het is algemeen bekend in de natuurkunde en scheikunde dat gelijke ladingen elkaar afstoten, terwijl tegengestelde ladingen elkaar aantrekken. Lange tijd werd aangenomen dat dit principe ook van toepassing is wanneer enzymen - de biologische katalysatoren in alle levende organismen - chemische bindingen vormen of verbreken. Men dacht dat enzymen ladingen plaatsen in hun 'actieve centra', waar de chemische reacties daadwerkelijk plaatsvinden, op zo'n manier dat ze soortgelijke ladingen afstoten van de andere moleculen om hen heen. Dit concept staat bekend als "elektrostatische stress". Als het substraat (de stof waarop het enzym inwerkt) bijvoorbeeld een negatieve lading draagt, zou het enzym een negatieve lading kunnen gebruiken om het substraat te "stressen" en zo de reactie te vergemakkelijken. Een nieuwe studie van de Universiteit van Göttingen en het Max Planck Instituut voor Multidisciplinaire Wetenschappen in Göttingen heeft nu echter aangetoond dat, in tegenstelling tot de verwachtingen, twee gelijke ladingen niet noodzakelijkerwijs leiden tot afstoting, maar aantrekking in enzymen kunnen veroorzaken. De resultaten zijn gepubliceerd in het tijdschrift Nature Catalysis .
Het team onderzocht een bekend enzym dat uitgebreid is bestudeerd en een schoolvoorbeeld is van enzymkatalyse. Zonder het enzym is de reactie extreem traag:in feite zou het 78 miljoen jaar duren voordat de helft van het substraat reageert. Het enzym versnelt deze reactie met 10 17 door simpelweg negatieve en positieve ladingen in het actieve centrum te plaatsen. Omdat het substraat een negatief geladen groep bevat die wordt afgesplitst als kooldioxide, werd decennialang aangenomen dat de negatieve ladingen van het enzym dienen om het substraat, dat ook negatief geladen is, te belasten en de reactie te versnellen. Dit hypothetische mechanisme bleef echter onbewezen omdat de structuur van de reactie te snel was om waar te nemen.
De groep van professor Kai Tittmann van het Göttingen Center for Molecular Biosciences (GZMB) is er nu voor het eerst in geslaagd om met eiwitkristallografie kort voor de chemische reactie een structurele momentopname van het substraat te maken. Onverwacht stoten de negatieve ladingen van enzym en substraat elkaar niet af. In plaats daarvan deelden ze een proton, dat werkte als een soort moleculaire lijm in een aantrekkelijke interactie. "De vraag of twee gelijke ladingen vrienden of vijanden zijn in de context van enzymkatalyse is al lang controversieel in ons vakgebied, en onze studie toont aan dat de basisprincipes van hoe enzymen werken nog lang niet worden begrepen", zegt Tittmann . De kristallografische structuren werden geanalyseerd door kwantumchemicus professor Ricardo Mata en zijn team van het Instituut voor Fysische Chemie van de Universiteit van Göttingen. "Het extra proton, dat een positieve lading heeft, tussen de twee negatieve ladingen, wordt niet alleen gebruikt om het molecuul dat bij de reactie betrokken is aan te trekken, maar veroorzaakt ook een cascade van protonoverdrachtsreacties die de reactie verder versnellen", legt Mata uit.
"Wij geloven dat deze nieuw beschreven principes van enzymkatalyse zullen helpen bij de ontwikkeling van nieuwe chemische katalysatoren", zegt Tittmann. "Aangezien het enzym dat we hebben bestudeerd koolstofdioxide afgeeft, het belangrijkste broeikasgas dat door menselijke activiteiten wordt geproduceerd, kunnen onze resultaten helpen bij het ontwikkelen van nieuwe chemische strategieën voor de fixatie van koolstofdioxide." + Verder verkennen
Hybride enzymkatalysatoren gesynthetiseerd door een de novo benadering voor het uitbreiden van biokatalyse
 Wat is zoutoplossing?
Wat is zoutoplossing?  Hoe probiotische bifidobacteriën patiënten met coeliakie kunnen helpen?
Hoe probiotische bifidobacteriën patiënten met coeliakie kunnen helpen? Ontwikkeling van een vast materiaal dat langzaam waterstofsulfide en stikstofmonoxide kan afgeven
Ontwikkeling van een vast materiaal dat langzaam waterstofsulfide en stikstofmonoxide kan afgeven Drukken maakt polymeren plat, verbetering van elektrische en optische eigenschappen
Drukken maakt polymeren plat, verbetering van elektrische en optische eigenschappen Nieuwe methode voor het labelen van DNA-basen voor sequencing
Nieuwe methode voor het labelen van DNA-basen voor sequencing
 Om honger aan te pakken, veel landen moeten mogelijk hun ecologische voetafdruk vergroten
Om honger aan te pakken, veel landen moeten mogelijk hun ecologische voetafdruk vergroten Cloudsimulaties krijgen een dosis realisme
Cloudsimulaties krijgen een dosis realisme Hoe waren de voorbereidingen voor onze vurige toekomst?
Hoe waren de voorbereidingen voor onze vurige toekomst? Kleinschalige visserij biedt strategieën voor veerkracht in het licht van klimaatverandering
Kleinschalige visserij biedt strategieën voor veerkracht in het licht van klimaatverandering Wat zijn de nieuwste toepassingen van aardgas?
Wat zijn de nieuwste toepassingen van aardgas?
Hoofdlijnen
- Economen ontwikkelen besluitvormingsmethode voor beheer van koraalduivels
- Het verhaal van evolutie geschreven in fosfor
- G2-fase: wat gebeurt er in deze subfase van de celcyclus?
- Met behulp van nieuwe techniek doen onderzoekers verrassende ontdekkingen over hoe vliegenhersenen reageren op smaken
- Masterchef-techniek blijkt levensreddend te zijn voor bedreigde zeeschildpadeieren
- Mariene wetenschappers ontdekken kleptopredatie - een nieuwe manier om prooien te vangen
- Is het ethisch om stamcellen te gebruiken?
- Wetenschappers ontdekken hoe SARS-CoV-2 antivirale afweer blokkeert
- Darmmicroben en mensen op een gezamenlijke evolutionaire reis
- Nieuwe verbinding onthult fundamentele eigenschappen van kleinste koolstofnanobuisjes

- Ingenieurs 3D printen zeer sterk aluminium, los eeuwenoud lasprobleem op met nanodeeltjes

- Nieuwe fluoroforen kunnen kanker helpen bestrijden

- Nieuw elektronisch apparaat detecteert explosieve dampen

- Zeesponzen inspireren de volgende generatie wolkenkrabbers en bruggen

 NGC 6357:Kosmisch winterwonderland
NGC 6357:Kosmisch winterwonderland Lijst van sommige soorten bacteriën gevonden in de bodem
Lijst van sommige soorten bacteriën gevonden in de bodem  'S Werelds eerste commerciële herprogrammeerbare satelliet schiet de ruimte in
'S Werelds eerste commerciële herprogrammeerbare satelliet schiet de ruimte in Hoe ozonvervuiling werkt
Hoe ozonvervuiling werkt  Hoeveel bewoonbare planeten zijn er?
Hoeveel bewoonbare planeten zijn er? Waarom kiezen zo weinig meisjes voor een loopbaan in de bouw?
Waarom kiezen zo weinig meisjes voor een loopbaan in de bouw? Zweden onthult nieuwe klimaatwet bekritiseert Trump
Zweden onthult nieuwe klimaatwet bekritiseert Trump Oogsten in de VS lijden onder klimaatverandering, volgens studie
Oogsten in de VS lijden onder klimaatverandering, volgens studie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

