
Wetenschap
Synthese van tetrafenylammonium:bevestiging van het bestaan van het fantoomion
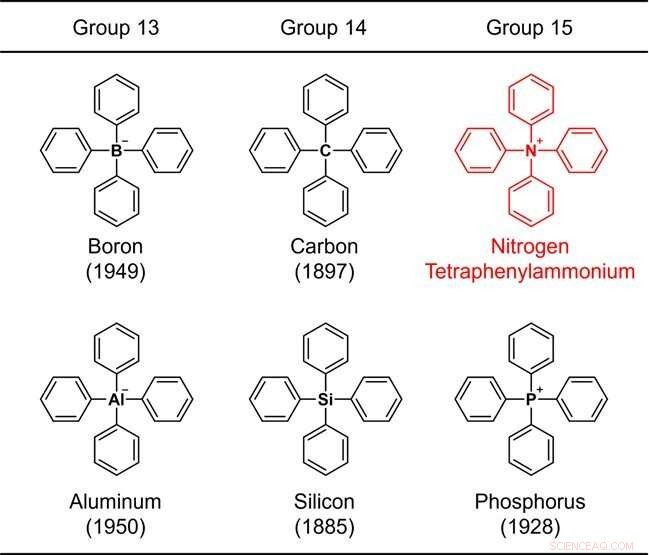
Figuur 1. Structuren van tetrafenyl-gesubstitueerde elementen die behoren tot de groepen 13-15. Het getal tussen haakjes geeft het jaar van synthese aan. Krediet:Kanazawa University
Tetrafenylammonium, met alle vier de waterstofatomen van ammonium (NH4 + ) vervangen door benzeenringen, is noch in de natuur ontdekt, noch chemisch gesynthetiseerd, wat de vraag oproept of het zou kunnen bestaan. Hier zijn we erin geslaagd om voor de eerste keer tetrafenylammonium te synthetiseren, wat het stabiele bestaan aantoont. De synthetische strategie die in deze studie wordt gebruikt, radicale koppeling, kan van toepassing zijn op de synthese van verschillende verwante ammoniumverbindingen met een hoge structurele nieuwheid. De studie is gepubliceerd in Nature Communications .
Aangezien de benzeenring een representatief bestanddeel van organische verbindingen is, wordt een structuur die alleen bestaat uit een gemeenschappelijk element plus de benzeenring beschouwd als een van de meest fundamentele chemische skeletten. Vanwege hun belang is de chemische synthese van dergelijke moleculen bestudeerd sinds de vroege dagen van de organische chemie. De structuur waarin vier benzeenringen zijn gebonden aan een representatief element (boor, koolstof, aluminium, silicium of fosfor) van groepen 13 tot 15 in het periodiek systeem (Fig. 1) werd bijvoorbeeld meer dan 70 jaar geleden gesynthetiseerd, en het oudste synthetische rapport dateert van 137 jaar oud.
Deze skeletten worden gezamenlijk "tetrafenyl" genoemd, wat betekent dat de structuur 4 benzeenringen bevat. Wanneer het centrale element stikstof, ammonium, NH4 . is + , wordt beschouwd als het moederion. Zo'n verbinding wordt tetrafenylammonium genoemd. Deze verbinding, in feite een ion, heeft een zeer eenvoudige chemische structuur die zelfs een beginner in de organische chemie zich gemakkelijk kan voorstellen.
Desalniettemin is het erg moeilijk gebleken om deze structuur kunstmatig te creëren en zijn er geen synthetische rapporten met duidelijke structuuridentificatie gepubliceerd. Bovendien, omdat het niet in de natuur is ontdekt, was het tot nu toe niet duidelijk of tetrafenylammonium überhaupt kan bestaan. Er zijn publicaties verschenen die het bestaan ervan veronderstellen en alleen het gebruik ervan vermelden zonder de synthese of acquisitiemethode te beschrijven. Samengestelde databases bevatten alleen de chemische structuur. Dus dit ion wordt soms aangeduid alsof het al bekend was. In werkelijkheid heeft echter niemand het waargenomen, waardoor tetrafenylammonium een "spookion" is geworden.
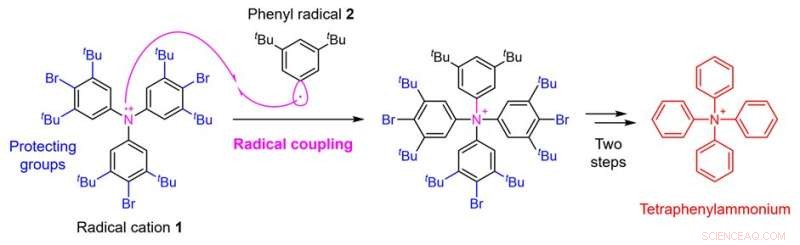
Figuur 2. Tetrafenylammoniumsynthesestrategie met behulp van radicale koppeling. Krediet:Kanazawa University
In deze studie heeft een onderzoeksteam van de Faculteit Farmaceutische Wetenschappen, Kanazawa University de synthese van tetrafenylammonium mogelijk gemaakt door een nieuwe synthetische strategie te ontwikkelen. Het kritieke punt bij de synthese van tetrafenylammonium is de toevoeging van de vierde fenylgroep aan het stikstofatoom waaraan al drie fenylgroepen zijn bevestigd. Men dacht dat het moeilijk was om deze synthese te bereiken met conventionele technieken. In de huidige studie paste het onderzoeksteam daarom een techniek toe die radicaalkoppeling wordt genoemd en gebruikte een strategie om het radicaalkation 1 bereid uit een trifenylaminederivaat met het fenylradicaal 2 te laten reageren (Fig. 2).
Hierdoor slaagde het onderzoeksteam erin om, hoewel de opbrengst slechts 0,1% was, de gewenste chemische omzetting uit te voeren. Bij dergelijke radicaalkoppelingen vormen zeer reactieve radicalen bindingen met elkaar, wat het voordeel heeft bindingsvorming mogelijk te maken die met andere methoden niet zou kunnen worden bereikt. Aan de andere kant heeft het het nadeel dat het moeilijk is om de selectiviteit te controleren omdat de reactiviteit te hoog is, wat leidt tot verschillende nevenreacties.
Daarom heeft het onderzoeksteam in deze synthese, om de nevenreactie van bindingsvorming op de koolstof van radicaal kation 1 zoveel mogelijk te onderdrukken, ook de introductie bedacht van beschermende groepen) die sterische hinder veroorzaken. Ten slotte werden in totaal vijf stappen van chemische omzetting van een bekend trifenylaminederivaat, het uitgangsmateriaal voor de synthese, uitgevoerd door de introductie van de beschermende groepen, radicaalkoppeling en daaropvolgende verwijdering van de beschermende groepen, wat leidde tot tetrafenylammonium.

Figuur 3. X-ray kristalstructuur van tetrafenylammonium. Krediet:Kanazawa University
Op basis van de gegevens verkregen uit verschillende instrumentele analyses, werd de structuur van tetrafenylammonium bevestigd. Röntgenkristallografie) onthulde dat de bindingslengte tussen het stikstofatoom en het fenylgroep-koolstofatoom in dit ion slechts 1,529 A is (Fig. 3).
Aangezien deze bindingslengte korter is dan die van een tetrafenylstructuur die een ander element bevat (boor, koolstof, aluminium, silicium of fosfor), is het duidelijk dat het stikstofatoom van tetrafenylammonium zich in een meer ruimtelijk gehinderde omgeving bevindt dan andere elementen. Deze driedimensionale belemmering wordt beschouwd als een van de factoren die het moeilijk maken om dit skelet te bouwen. Verder onthulden onze resultaten ook dat tetrafenylammonium een hoge stabiliteit heeft om sterk zure en basische omstandigheden te weerstaan.
De huidige studie heeft aangetoond dat tetrafenylammonium inderdaad bestaat en chemisch kan worden gesynthetiseerd. Als in de toekomst grootschalige synthese van dit ion en zijn derivaten wordt gerealiseerd, kan het mogelijk worden toegepast in verschillende onderzoeksgebieden als een organisch kation met een hoge chemische stabiliteit. Bovendien kan de radicale koppelingsstrategie die in deze studie wordt gebruikt, van toepassing zijn op de synthese van andere verwante ammoniumverbindingen die tot nu toe niet konden worden gemaakt. + Verder verkennen
Vorming van arylradicaal door splitsing van arylhalogenidebindingen door een N-heterocyclische carbeenkatalysator
 Nieuw onderzoek naar nucleaire magnetische resonantiespectroscopie onthult de dynamiek van katalysatoren in de 3D-ruimte
Nieuw onderzoek naar nucleaire magnetische resonantiespectroscopie onthult de dynamiek van katalysatoren in de 3D-ruimte Spontaan patronen creëren in synthetische materialen
Spontaan patronen creëren in synthetische materialen Onderzoekers boeken vooruitgang in de controle over kameleonachtig materiaal voor computers van de volgende generatie
Onderzoekers boeken vooruitgang in de controle over kameleonachtig materiaal voor computers van de volgende generatie Doorbraak in magnesiumbatterijen:nanogestructureerde kathode, begrip van nieuwe elektrolyt leidt tot grotere efficiëntie
Doorbraak in magnesiumbatterijen:nanogestructureerde kathode, begrip van nieuwe elektrolyt leidt tot grotere efficiëntie Wat is een instabiel atoom?
Wat is een instabiel atoom?
 Hoe beïnvloeden tropische cyclonen de luchtkwaliteit in Hong Kong?
Hoe beïnvloeden tropische cyclonen de luchtkwaliteit in Hong Kong? Onderzoekers bestuderen de ingewikkelde link tussen klimaat en conflict
Onderzoekers bestuderen de ingewikkelde link tussen klimaat en conflict Handel in wilde dieren en meer belemmeren de duurzame ontwikkeling van landen
Handel in wilde dieren en meer belemmeren de duurzame ontwikkeling van landen Verpletterende klimaateffecten zullen sneller toeslaan dan gevreesd:concept VN-rapport
Verpletterende klimaateffecten zullen sneller toeslaan dan gevreesd:concept VN-rapport Nieuwe studie kwantificeert diepe reactie achter superdiepe diamanten
Nieuwe studie kwantificeert diepe reactie achter superdiepe diamanten
Hoofdlijnen
- Een nieuwe manier om mRNA-genomen af te leveren:nucleocapsiden met evolutionaire eigenschappen
- We kregen te maken met misbruik omdat we mensen vroegen om wespen te doden voor de wetenschap - hier is waarom het de moeite waard was
- Wat is perifeer bloed?
- Netwerkopbouw door celdeling:hoe zenuwcellen in de hersenen verbinding maken tijdens de ontwikkeling
- Wat is de schijfachtige structuur aan de zijde van chloroplasten?
- Woestijn in Zuid-Californië overspoeld met de beste superbloei in 20 jaar
- De juiste manier om DNA te repareren
- Interessante feiten over plantencellen
- Gouden nanodeeltje gebruikt om virus te vervangen in nieuwe CRISPR-aanpak
- Chitinase als verbrande brug Brownse monorail die op efficiënte wijze recalcitrante biomassa hydrolyseert
- Verandert zout de pH van water?

- Virussen onderscheiden, vernietigen E. coli in drinkwater
- Op lipiden gebaseerde grensgesmeerde hydrogels bleken gladder te zijn dan die op basis van water
- Een mooie reactie daarop:nieuwe synthetische routes voor diverse aromatische verbindingen
 Goonhilly-antenne gaat diep in de ruimte
Goonhilly-antenne gaat diep in de ruimte Wat voor soort ontwikkeling heeft geen plaats voor een miljard sloppenwijkbewoners?
Wat voor soort ontwikkeling heeft geen plaats voor een miljard sloppenwijkbewoners? Veertig jaar later, Voyager raast nog steeds door de ruimte
Veertig jaar later, Voyager raast nog steeds door de ruimte Nylons eigenschappen & toepassingen
Nylons eigenschappen & toepassingen  Dekkingskosten terugverdiend op Rolling Plains-katoen
Dekkingskosten terugverdiend op Rolling Plains-katoen Hoe wordt Glycerol gemaakt?
Hoe wordt Glycerol gemaakt?
Glycerol is een veelzijdige verbinding die wordt gebruikt om zeep, lotion, nitroglycerine, conserveermiddelen en smeermiddelen te maken. Het begrijpen van de structuur van glycerol is de sleutel tot het begrijpen van de
 Onderzoekers vergroten het begrip van vortex-verspreiding in supervloeistoffen
Onderzoekers vergroten het begrip van vortex-verspreiding in supervloeistoffen EU heroverweegt hulp voor civiele bescherming na branden in Portugal
EU heroverweegt hulp voor civiele bescherming na branden in Portugal
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

