
Wetenschap
Elektrische velden in kaart brengen om te helpen ontrafelen hoe enzymen werken
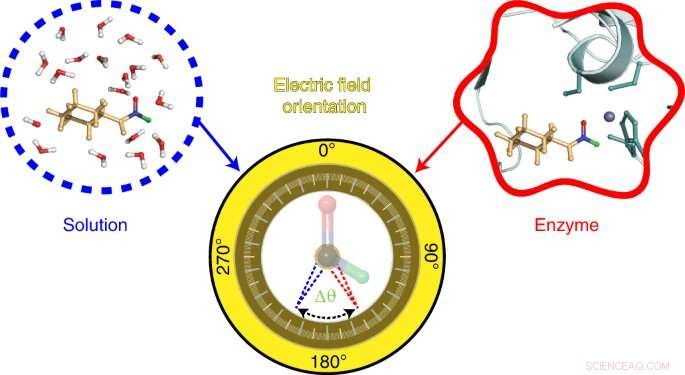
Grafisch abstract. Krediet:Natuurchemie (2022). DOI:10.1038/s41557-022-00937-w
Elk moment in de cellen van ons lichaam vinden dankzij enzymen talloze activiteiten plaats die van vitaal belang zijn voor het leven. Deze speciale eiwitten werken als katalysatoren door het tempo te versnellen en de selectiviteit van chemische reacties te verbeteren zonder zelf permanente veranderingen te ondergaan. Naast hun onmisbare rol in de biologie, zijn enzymen ook van cruciaal belang voor talloze processen in de voedings-, farmaceutische, landbouw- en cosmetica-industrie.
In tegenstelling tot hun alomtegenwoordigheid en belang, worden enzymen slecht begrepen. In het bijzonder willen wetenschappers weten wat de actieve sites van enzymen - het zakachtige gebied waar de versnelde chemische reacties plaatsvinden - zo krachtig maakt. Hoewel de driedimensionale atomaire structuren van de actieve plaatsen van veel enzymen zijn gevisualiseerd en in kaart zijn gebracht, is de "onzichtbare" structuur van de elektrische velden binnen een actieve plaats grotendeels onbekend. Er wordt aangenomen dat die elektrische velden een belangrijke rol spelen bij het vormen van een precieze omgeving op actieve plaatsen waar moleculen reageren en snel overgaan naar nieuwe moleculen.
Nu heeft een studie onder leiding van Stanford-onderzoekers Chu Zheng en Yuezhi Mao een nieuwe sonde geïntroduceerd voor het meten en visualiseren van de elektrische velden in de actieve plaats van een enzym. Het artikel, onlangs gepubliceerd in het tijdschrift Nature Chemistry , rapporteert over de oriëntatie van elektrische velden op de plaats van de reactie en zou onderzoekers kunnen helpen bij het berekenen van de belangrijkste chemische interacties in actieve sites. Deze inzichten zouden op hun beurt kunnen leiden tot het bouwen van op maat gemaakte synthetische enzymen voor de industrie, evenals tot een grote vooruitgang in de ontdekking en het ontwerp van nieuwe geneesmiddelen die interfereren met of de functie van enzymdoelen moduleren.
"We hebben een nieuwe sonde ontwikkeld die ons belangrijke informatie kan geven over hoe elektrische velden uniek georiënteerd zijn in enzymen, waarvan we denken dat het fundamenteel is voor de verbazingwekkende katalytische kracht van enzymen", zegt Zheng, een afgestudeerde student in het laboratorium van Steven G. Boxer, de Camille Dreyfus hoogleraar scheikunde.
"Op een basisniveau proberen we beter te begrijpen hoe enzymen werken, en in deze studie voegen we een nieuwe dimensie toe door elektrische veldoriëntaties in te voeren waarvan wordt aangenomen dat ze een kritische invloed hebben op de katalytische functies van het enzym," zei Mao, een postdoctoraal wetenschapper in de chemie die werkt in het laboratorium van Thomas Markland, een universitair hoofddocent chemie aan Stanford en ook een senior co-auteur.
Een krachtige nieuwe tool
Het Boxer-lab in Stanford heeft een pioniersrol vervuld in het concept van het interpreteren van de functionaliteit van enzymen door elektrostatische interacties te meten, die aanwezig zijn in alle vormen van materie en specifiek in drie dimensies zijn georganiseerd in grote biologische moleculen.
"De oorsprong van de verbazingwekkende functionaliteit van enzymen is een algemene vraag, en het is niet alleen van toepassing op biologische katalyse, maar ook op chemische katalyse, wat een enorme onderneming is", zei Boxer. "Ongeveer 80 procent van alle chemicaliën wordt gemaakt met behulp van katalysatoren, maar wat eigenlijk verantwoordelijk is voor het verlagen van de activeringsvrije energie [om de reactie sneller te laten plaatsvinden] is niet goed begrepen voor de meeste reacties. Het onderzoeken van de rol van elektrische velden in de enzymfunctie is zeer vormt de kern van ons werk", zegt Boxer, de voorzitter van de afdeling Scheikunde aan de Stanford's School of Humanities and Sciences en een senior co-auteur van de studie.
De sonde die door het Stanford-team is ontwikkeld, is gebaseerd op een techniek - ook ontwikkeld in het Boxer-lab - genaamd vibrationele Stark-effectspectroscopie. Deze techniek meet de trillingsfrequenties in sondemoleculen op basis van de golflengte van infrarood licht dat wordt geabsorbeerd door zijn chemische bindingen. Verschuivingen in deze trillingsfrequenties onthullen informatie over de aanwezige elektrische velden. In deze studie onderzochten de onderzoekers verschuivingen in de trillingsfrequenties van chemische bindingen in een sonde gemaakt van een molecuul genaamd N-cyclohexylformamide. Dit molecuul werkt als een remmer en bindt aan de actieve plaats van een enzym dat leveralcoholdehydrogenase wordt genoemd.
To visualize the electric field in the active site of liver alcohol dehydrogenase, the researchers targeted two bonds in the N-cyclohexylformamide probe about 120 degrees away from each other. That specific angle between the two bonds allowed the researchers to gauge not only the strength, or magnitude, of the electric field, but also the field's orientation. Previous studies from the Boxer lab on other enzyme active sites had reported on the magnitude of electric fields but not on their directions.
"We call this tool a two-directional probe because with this probe we can measure the electric field in an active site in two different directions," Zheng said. "Using the probe this way, we can reconstruct and extract the orientation information about the electric field. That hasn't been done in the past."
Gathering this key measurement first required some chemical sleight of hand. One of the N-cyclohexylformamide probe's chemical bonds—between a carbon atom and a hydrogen atom—is notoriously difficult to observe in protein environments. So, the researchers swapped the hydrogen atom for the element's heavier cousin, called deuterium. The new carbon–deuterium bond proved amenable to measurement, and helped the researchers reveal the orientation of the electric field.
A precise enzymatic environment
The Stanford researchers combined their experimental data with computer simulations and quantum mechanical calculations to describe the electric field's interactions with N-cyclohexylformamide, modified with deuterium, at the active site of liver alcohol dehydrogenase. Those properties were then compared to the electric fields found in water, acetone, and other common solvents.
Notably, the researchers found the orientation of the electric field in the active site of liver alcohol dehydrogenase differs considerably from the electric field orientation in the solvents they studied. That result supports the idea that enzyme active sites feature what scientists call a preorganized electrostatic environment, or one in which the precise positioning of amino acids and the electrostatic environment they create help reduce the energy required for a chemical reaction to take place. This could be a key to enzymes' remarkable ability to catalyze reactions.
"With this study, we are helping to advance the concept of correlating the performance of enzymes with both the magnitude and orientation of the electric fields in active sites," Mao said. "What we have found is evidence that electric fields in the enzyme active sites are preorganized, and that is an important clue in solving the mystery of why enzymes have their amazing abilities."
The probe developed by the Stanford researchers could be used to investigate many other enzymes' active sites. Broadening knowledge in this way will bring scientists and engineers closer to being able to design bespoke enzymes with spectacular new characteristics.
"The ultimate goal of this research is to enable us to design enzymes that have superb catalytic performance for biomedical and industrial application," Zheng said. "We are still far from that, but we are making progress and have a better understanding now than before regarding how enzymes work." + Verder verkennen
An enzyme's evolution from changing electric fields and resisting antibiotics
 Verbindingen in een Aziatische gefermenteerde vispasta kunnen een hoog cholesterolgehalte verlagen
Verbindingen in een Aziatische gefermenteerde vispasta kunnen een hoog cholesterolgehalte verlagen Uitbreidbaar schuim voor 3D-printen van grote objecten
Uitbreidbaar schuim voor 3D-printen van grote objecten Chemisch complex kan de uitscheiding van radioactief strontium uit het lichaam verbeteren
Chemisch complex kan de uitscheiding van radioactief strontium uit het lichaam verbeteren Een onderzoek naar de instabiliteit van het rozenvenster
Een onderzoek naar de instabiliteit van het rozenvenster Probiotische hydrogels genezen darmwonden waar andere verbanden niet bij kunnen
Probiotische hydrogels genezen darmwonden waar andere verbanden niet bij kunnen
Hoofdlijnen
- Wanneer vissen:Timing is belangrijk voor vissen die migreren om zich voort te planten
- Onderzoekers vinden dat er minstens 14, 003 plantensoorten in het Amazonebekken
- Zijn mannen gewelddadiger dan vrouwen?
- De rol van de longen
- Team onderzoekt mechanismen voor geslachtsbepaling bij vogels
- Hartmonitors op wilde narwallen onthullen alarmerende reacties op stress
- Een door kracht aangedreven mechanisme voor het vaststellen van celpolariteit
- Wat zijn enkele materialen die ik zou kunnen gebruiken om plantencellen te maken?
- Waarom het een goed idee is om met je dronken oom over politiek te praten
- Een nieuw recept voor luchtstabiel en hoogkristallijn radicaal-gebaseerd coördinatiepolymeer
- Een computermodel heeft geleerd prostaatkanker op te sporen

- Onderzoek naar biomimicry - het bouwen van de volgende generatie aanpasbare materialen uit de natuur

- Nieuw onderzoek verklaart waarom sommige moleculen onregelmatige vormen hebben

- Grootschalig en duurzaam 3D-printen met het meest alomtegenwoordige natuurlijke materiaal

 4 visies op hoe technologie en innovatie de planeet zullen voeden
4 visies op hoe technologie en innovatie de planeet zullen voeden  Hoe de zijlengten van driehoeken te vinden
Hoe de zijlengten van driehoeken te vinden  Mijnbouw voor Mars
Mijnbouw voor Mars Frequentietabellen maken
Frequentietabellen maken  Automatisering verdubbeld in wereldwijde productie
Automatisering verdubbeld in wereldwijde productie Zuid-Korea lanceert eerste nationale 5G-netwerken ter wereld
Zuid-Korea lanceert eerste nationale 5G-netwerken ter wereld Antarctische stations worden geteisterd door seksuele intimidatie. Het is tijd dat dingen veranderen
Antarctische stations worden geteisterd door seksuele intimidatie. Het is tijd dat dingen veranderen De effecten van klimaatverandering op watertekorten
De effecten van klimaatverandering op watertekorten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

