
Wetenschap
Een algemeen chemisch principe voor het maken van sluitingsstabiliserende integrineremmers
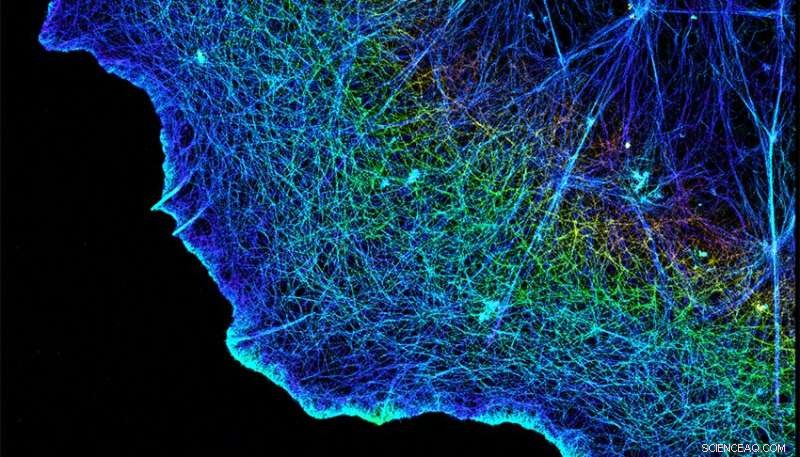
Integrines verbinden de fibreuze cytoskeletten van cellen, hier weergegeven, met de matrix die hen omringt. Krediet:Xiaowei Zhuang/HHMI/Harvard University/Nature Publishing Group
Noem een biologische functie, en eiwitten die integrines worden genoemd, zijn er waarschijnlijk bij betrokken.
Samen zorgen de 24 leden van de integrinefamilie ervoor dat cellen zich aan elkaar en aan de matrix eromheen hechten. Ze helpen cellen te beslissen wat ze moeten worden, waar ze heen moeten, hoe ze moeten reageren op hun omgeving en wanneer ze moeten groeien, delen of sterven.
De alomtegenwoordigheid en veelzijdigheid van Integrins betekent ook dat wanneer cellen die ze dragen misgaan, deze eiwitten kunnen bijdragen aan een reeks ziekten, van auto-immuunziekten tot kanker.
De FDA heeft tot dusver zes geneesmiddelen goedgekeurd die de activiteit van specifieke integrines verminderen om ziekten zoals multiple sclerose en colitis ulcerosa te behandelen en om de vorming van bloedstolsels te voorkomen. Tot teleurstelling van wetenschappers, artsen en patiënten hebben andere veelbelovende kandidaten echter gefaald in klinische onderzoeken en hebben ze het potentieel van integrines als behandelingsdoelen ingeperkt.
Nieuw werk onder leiding van onderzoekers van de Harvard Medical School en het Boston Children's Hospital onthult een reden voor de mislukkingen en biedt een mogelijke oplossing.
Timothy Springer, de Latham Family Professor of Biological Chemistry and Molecular Pharmacology bij HMS en Boston Children's, en collega's, hebben een integrine die betrokken is bij bloedstolling onder de loep genomen en ontdekten dat mislukte medicijnen voor twee verschillende integrines de integrines onbedoeld aanmoedigden om zich open te stellen in hun "aan"-positie, waardoor de integrine-activiteit mogelijk wordt gestimuleerd in plaats van deze te onderdrukken.
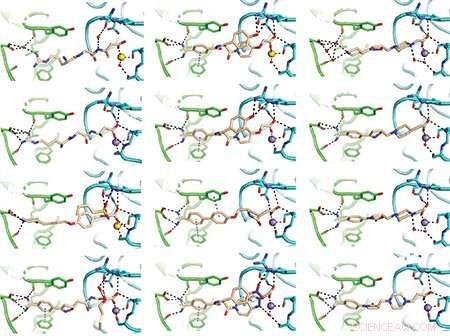
Het team deed enkele van zijn ontdekkingen met behulp van röntgenkristallografie, een zorgvuldige methode om de moleculaire structuren van eiwitten te bepalen. Dit zijn enkele van de resulterende diagrammen van geneesmiddelen die zijn gebonden aan het stolselgerelateerde integrine. Afbeeldingen:Fu-Yang Lin, Jing Li, Yonghua Xie, et al., Cell
Het team onthulde dat de integrine in zijn gesloten of "uit" -positie een watermolecuul bevat dat op zijn plaats wordt gehouden door een reeks chemische bindingen. De integrine stoot het watermolecuul uit wanneer het wordt geactiveerd.
Toen ze eenmaal wisten wat er aan de hand was, waren de onderzoekers in staat integrineblokkers te ontwerpen die het stollingseiwit in zijn "uit"-positie brachten door het watermolecuul op zijn plaats te houden met een stikstofatoom.
Verdere tests wezen erop dat watermoleculen dezelfde rol spelen in andere integrines, wat aangeeft dat de strategie van het team breder zou kunnen werken.
De bevindingen, gepubliceerd in het tijdschrift Cell smeed op 15 september een duidelijker pad voor de ontwikkeling van geneesmiddelen en vergroot het inzicht van onderzoekers in hoe integrines normaal werken.
"Hetzelfde ontwerpprincipe van watergebruik is al uitgebreid naar een andere integrine, en structurele informatie suggereert dat onderzoekers medicijnen kunnen ontwerpen om andere leden van de integrinefamilie te targeten om ziekten te behandelen die veel lijden veroorzaken," zei Springer, die lid is van het programma in cellulaire en moleculaire geneeskunde bij Boston Children's.
"Het geeft altijd voldoening om aan een project te werken dat zowel wetenschappelijk als medisch belangrijk is", voegde hij eraan toe. + Verder verkennen
Eiwitten houden grip op cellen
 NASA observeert grote stofpluim uit de Sahara boven de Atlantische Oceaan
NASA observeert grote stofpluim uit de Sahara boven de Atlantische Oceaan Waarom Irma in Florida niet zo catastrofaal was als gevreesd?
Waarom Irma in Florida niet zo catastrofaal was als gevreesd? Beschouwingen over COVID-19 en onze vernietiging van de natuur
Beschouwingen over COVID-19 en onze vernietiging van de natuur NASA vindt tyfoon Maysak in de buurt van Okinawa, Japan
NASA vindt tyfoon Maysak in de buurt van Okinawa, Japan Antarctische gletsjer vernoemd naar GFZ-satellietmissie GRACE
Antarctische gletsjer vernoemd naar GFZ-satellietmissie GRACE
Hoofdlijnen
- 10 soorten studievooroordelen
- Vrouwelijke vissen houden van zingende mannetjes
- Wetenschapsprojecten over Dominant en Recessieve Genen
- Dode vissen stapelen zich op aan de kusten van de San Francisco Bay Area:een giftige algenbloei is de waarschijnlijke oorzaak
- Hoe zijn dieren en planten vergelijkbaar?
- Combinatie van warmer water, blootstelling aan chemicaliën versterkt schadelijke effecten bij een kustvis
- De meest voorkomende organische moleculen in cellen
- Is er een verband tussen beweging en geluk?
- DNA is digitaal geworden - wat kan er mis gaan?
- Nieuw materiaal gemaakt om de fossiele brandstofindustrie op te ruimen

- Eenvoudige test kan fluoridegerelateerde ziekte voorkomen

- Eindelijk een cruciaal enzym onthuld
- Wetenschappers ontdekken verbinding die zich richt op kankercellen die het beschermende p53-voogdgen missen
- NIST vindt een manier om het printen van brandstofcellen met een snelle clip te meten

 Azijnexperiment voor endotherme en exotherme reacties
Azijnexperiment voor endotherme en exotherme reacties  Beste van het beste:wie neemt de meest nauwkeurige beslissingen in expertgroepen?
Beste van het beste:wie neemt de meest nauwkeurige beslissingen in expertgroepen? Hoe bereken ik de stijging van de temperatuur?
Hoe bereken ik de stijging van de temperatuur?  Geen gas meer:gasverlies zorgt voor een onderbreking van de sterrenbabyboom
Geen gas meer:gasverlies zorgt voor een onderbreking van de sterrenbabyboom Moleculair dunne hybride perovskiet voor geavanceerde opto-elektronische toepassingen
Moleculair dunne hybride perovskiet voor geavanceerde opto-elektronische toepassingen Revolutionair nieuw wapen in de strijd tegen luchtvervuiling
Revolutionair nieuw wapen in de strijd tegen luchtvervuiling Twee astronomen, honderd jaar uit elkaar, sterren gebruiken om het heelal te meten
Twee astronomen, honderd jaar uit elkaar, sterren gebruiken om het heelal te meten Huawei-eenheid schrapt meer dan 600 banen na Amerikaanse sancties
Huawei-eenheid schrapt meer dan 600 banen na Amerikaanse sancties
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

