Wetenschap
Een winnende combinatie voor glycoproteïnesynthese

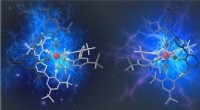
Glycoproteïnesynthese door chemische insertie met behulp van een door thiozuur gemedieerde strategie:de methode assembleert een volledig glycoproteïnesegment in twee stappen. Krediet:Universiteit van Osaka
Veel processen in het lichaam worden gereguleerd door de functies van eiwitten. Bijvoorbeeld, bijna alle moleculen, zoals DNA, eiwitten, oligosachariden, en kleine bioactieve moleculen - worden gegenereerd door enzymen. Echter, veranderingen in eiwitfuncties als reactie op abnormale omstandigheden veroorzaken kritieke ziekten. Onderzoekers van de Universiteit van Osaka hebben een snelle, robuuste chemische methode voor het bereiden van de zeer zuivere (homogene) glycoproteïnen die nodig zijn om deze veranderingen te onderzoeken. Hun bevindingen werden gepubliceerd in de Tijdschrift van de American Chemical Society .
De werkzaamheid van enzymen en functionele eiwitten wordt gereguleerd door eiwitmodificaties. Een typische eiwitmodificatie is glycosylering - het toevoegen van suikerketens, glycanen genaamd, aan eiwitten om glycoproteïnen te geven. Glycoproteïnen worden aangetroffen op het celoppervlak en in lichaamsvloeistoffen en spelen een belangrijke rol in veel biologische processen. Echter, de gevormde glycoproteïnen kunnen veel verschillende glycaanstructuren hebben. Daarom, bestuderen welke glycaanstructuren essentieel zijn voor individuele biologische gebeurtenissen is een uitdaging.
De productie van glycoproteïnen zoals biologische geneesmiddelen - therapeutische middelen geproduceerd uit, of bevattende componenten van, levende organismen - gebruikt zoogdiercelexpressiemethoden, maar het is niet mogelijk om de structuur van het aan het eiwit toegevoegde glycaan te reguleren. Chemische synthese is daarom de beste manier om homogene glycoproteïnen te maken die geschikt zijn voor basale biologische experimenten. Echter, chemische methoden vereisen meer dan 100 chemische conversiestappen en zijn tijdrovend.
De Osaka-onderzoekers identificeerden een ongekende en efficiënte amidebindingsvormingsreactie tussen glycan-aminozuur en twee peptiden:diacyldisulfidekoppeling en thiozuur-capture-ligatie. Ze toonden aan dat glycosylasparaginethiozuur een uitstekende chemoselectieve koppeling met peptiden vertoonde, en de gebruikte omstandigheden zouden glycosylpolypeptide kunnen genereren binnen enkele chemische omzettingsstappen.
"We gebruikten in wezen de glycosyl-asparagine om een verbinding te vormen tussen twee functionele peptiden, het geven van een glycoproteïne, " legt studie eerste auteur Kota Nomura uit. "We hebben dit in slechts een paar stappen bereikt, waardoor het een zeer efficiënte aanpak is met weinig verspilling van waardevolle glycaanmaterialen."
Het team demonstreerde de haalbaarheid van hun techniek door twee cytokine-glycoproteïnen te synthetiseren. Cytokinen zijn belangrijke bioactieve moleculen die betrokken zijn bij ontstekingen en immuunreacties. Het betrouwbaar produceren ervan leverde daarom een belangrijk bewijs van het nut van de nieuwe syntheseroute.
"We hebben een betrouwbare manier aangetoond om glycoproteïnen te synthetiseren die de grondige studie van de biologische functie van glycan mogelijk zullen maken, evenals het genereren van biologische geneesmiddelen, " legt studie corresponderende auteur Yasuhiro Kajihara uit.
 Hoe Amp om te zetten in elektronen per seconde
Hoe Amp om te zetten in elektronen per seconde  Door zelfassemblage geïnduceerde luminescentie van Eu3+-complexen voor bioimaging-toepassing
Door zelfassemblage geïnduceerde luminescentie van Eu3+-complexen voor bioimaging-toepassing Enkele moleculen vastgelegd op video met een ongekende 1, 600 beelden per seconde
Enkele moleculen vastgelegd op video met een ongekende 1, 600 beelden per seconde Onderzoek toont aan dat het doen van de twist hot is, ontspannen is cool
Onderzoek toont aan dat het doen van de twist hot is, ontspannen is cool Hoe theoretische H3O berekenen
Hoe theoretische H3O berekenen
Hoofdlijnen
- Wat zijn de verschillen tussen een oog van een koe en een menselijk oog?
- Een benadering van het hele lichaam om chemosensorische cellen te begrijpen
- Onderzoekers creëren nieuwe letters om DNA-functies te verbeteren
- Bereidheid om risico's te nemen - een persoonlijkheidskenmerk
- Sociale gevoeligheid:leider-volger dynamiek van invloedrijke individuen in een sociale groep
- Designer biosensor kan de productie van antibiotica door microben detecteren
- Dino-dodende asteroïde versnelde evolutie van vogels
- Kun je iemand echt doodsbang maken?
- Hoe werkt ureum denatureiwitten?
 CEO van Xerox blijft aan omdat deadline Icahn-deal afloopt
CEO van Xerox blijft aan omdat deadline Icahn-deal afloopt Werkt terrorisme? We hebben 90 groepen bestudeerd om het antwoord te krijgen
Werkt terrorisme? We hebben 90 groepen bestudeerd om het antwoord te krijgen Californië kan instorten voor een once-in-a-millennium-regenbui - hier is wat u moet weten
Californië kan instorten voor een once-in-a-millennium-regenbui - hier is wat u moet weten  Warmte- en geluidsgolfinteracties in vaste stoffen kunnen motoren laten draaien, koelkasten
Warmte- en geluidsgolfinteracties in vaste stoffen kunnen motoren laten draaien, koelkasten Waarom we nieuwe klimaatmodellen nodig hebben
Waarom we nieuwe klimaatmodellen nodig hebben Nieuwe 3D-printbenadering maakt roosterstructuren op celschaal
Nieuwe 3D-printbenadering maakt roosterstructuren op celschaal DNA met een twist:ontdekking zou de ontwikkeling van antibiotica kunnen bevorderen
DNA met een twist:ontdekking zou de ontwikkeling van antibiotica kunnen bevorderen Australië beleeft heetste zomer ooit beetje opluchting in zicht
Australië beleeft heetste zomer ooit beetje opluchting in zicht
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com