
Wetenschap
Hoe weet een regulerend eiwit waar het moet binden om de insulineproductie te moduleren?
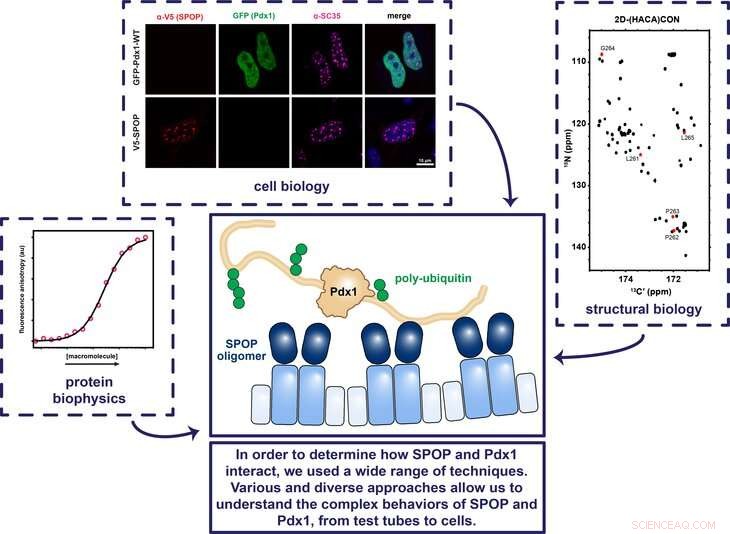
Penn State-onderzoekers gebruikten verschillende technieken met betrekking tot celbiologie, structurele biologie, en eiwitbiofysica om te bepalen hoe de eiwitten SPOP en Pdx1 samenwerken om ervoor te zorgen dat het gen dat codeert voor insuline op het juiste moment wordt in- en uitgeschakeld. Krediet:Showalter Lab, Penn State
Sommige eiwitten in het lichaam zorgen ervoor dat genen op de juiste momenten aan- en uitgezet worden. Bijvoorbeeld, het transcriptiefactor eiwit Pdx1 (pancreas en duodenum homeobox 1) zet het gen aan dat codeert voor insuline, en het eiwit SPOP (speckle-type POZ-eiwit) bindt op zijn beurt aan Pdx1 zodat het lichaam niet te veel insuline aanmaakt. Maar het is onduidelijk hoe SPOP bindt aan Pdx1. Begrijpen waar SPOP bindt, kan onderzoekers helpen te voorspellen wat individuen vatbaar maakt voor het ontwikkelen van diabetes en om te verduidelijken hoe SPOP andere belangrijke eiwitten reguleert. In een recente studie, een team van onderzoekers van Penn State en St. Jude Children's Research Hospital heeft de eiwitten in beeld gebracht en bepaald hoe deze belangrijke interactie plaatsvindt.
Een paper waarin de interactie wordt beschreven, is onlangs gepubliceerd in de Tijdschrift voor biologische chemie . We spraken met twee van de auteurs van het artikel, Scott Showalter, hoogleraar scheikunde en biochemie en moleculaire biologie, en Emery Usher, afgestudeerde student Biochemie, Programma Microbiologie en Moleculaire Biologie (BMMB), over dit werk.
V:Waarom is Pdx1 belangrijk voor het menselijk lichaam, en hoe ondersteunt SPOP zijn functie?
Showalter:Pdx1 is een transcriptiefactor, dat is een eiwit dat zich bindt aan het DNA in uw genoom en bepaalt of nabijgelegen genen worden in- of uitgeschakeld. In mensen, Pdx1 wordt voornamelijk gevonden in de pancreas, waar het het gen aanzet dat codeert voor het eiwit insuline wanneer er meer van nodig is. Als er voldoende insuline is opgeslagen voor de toekomst, SPOP bindt aan Pdx1 en zorgt ervoor dat het wordt vernietigd door de cellulaire eiwitrecyclingmachines, waardoor de insulineproductie wordt uitgeschakeld.
Usher:Uiteindelijk Pdx1 en SPOP werken samen om de glucosehomeostase te behouden; dat is, de zorgvuldige balans van de glucosespiegels in de cellen en in uw bloedbaan. Opmerkelijk, SPOP vervult een vergelijkbare regulerende rol voor tientallen andere eiwitten in veel verschillende soorten cellen, die allemaal van cruciaal belang zijn voor de juiste celfunctie.
Vraag:Wat was uw motivatie voor dit onderzoek?
Showalter:Hoewel we wisten dat Pdx1 en SPOP samenwerken om het insulinecoderende gen te reguleren, voorafgaand aan deze studie waren de details van deze interactie onduidelijk. Uit ander werk was bekend dat SPOP eiwitten uitschakelt door er een moleculair signaal aan te koppelen dat deze eiwitten als doelwit heeft voor vernietiging. maar Pdx1 lijkt niet op andere eiwitten die door SPOP worden gereguleerd. Bijna alle eiwitten waarvan bekend is dat ze worden gereguleerd door SPOP, hebben meerdere herkenningssequenties, of sequenties van aminozuren die werken als een wachtwoord. Echter, Pdx1 bevat geen van de sequenties waarvan bekend was dat SPOP eraan bindt. Mijn laboratorium heeft de afgelopen tien jaar veel energie gestoken in het ontwikkelen van technieken die kunnen worden gebruikt om interacties te karakteriseren zoals we wisten dat die tussen Pdx1 en SPOP moesten bestaan. In dit onderzoek, we wilden bepalen waar SPOP bindt aan Pdx1 en hoe het weet dat het de juiste site(s) heeft gevonden.
Usher:SPOP kan meer dan één van deze aminozuurwachtwoorden herkennen en kan zich dus op veel partners richten, het is dus moeilijk om een uitgebreide lijst te maken van de aminozuursequenties waarnaar SPOP zoekt. Onderzoek naar de interactie tussen Pdx1 en SPOP zou ook inzicht kunnen geven in andere eiwitten waaraan SPOP zou kunnen binden.
Vraag:Wat waren de belangrijkste resultaten van dit onderzoek?
Showalter:We waren erg blij te ontdekken dat er niet slechts één SPOP-bindingssite is op Pdx1, maar twee. Het is bekend dat SPOP in het algemeen meerdere plaatsen bindt in de eiwitten die het controleert, dus dit resultaat was zeer bevredigend omdat het de Pdx1-regelgeving in overeenstemming brengt met het meer algemene begrip van de gemeenschap over hoe SPOP werkt. Nadat we de tweede bindingsplaats hadden gevonden, we gebruikten röntgenkristallografie om het complex in beeld te brengen dat ontstaat wanneer SPOP wordt gebonden aan Pdx1 op deze nieuw ontdekte bindingsplaatsen. Deze structuur onthulde dat hoewel een ongebruikelijke sequentie van aminozuren in Pdx1 betrokken was bij SPOP-binding, de geometrische en chemische details leken eigenlijk erg op eerder bepaalde structuren. Onze resultaten suggereren dat de eerdere definitie van een SPOP-bindingsplaats te smal was.
Usher:We hebben nu een beter begrip van de chemische regels die bepalen of een sequentie een goede kandidaat is om te binden of niet. Onze structuur suggereert ook een plausibel mechanisme om Pdx1-binding door SPOP te verstoren wanneer deze interactie ongewenst is, bijvoorbeeld wanneer Pdx1 nodig is om meer insuline te produceren.
V:Waarom zijn deze bevindingen belangrijk?
Showalter:Het is belangrijk om de moleculaire details van biologische processen zoals glucoseafhankelijke insulineproductie te begrijpen en hoe deze worden gereguleerd, omdat dit de beslissende factoren zijn tussen normale gezondheid en ziekte. Inzicht in de sequenties waaraan SPOP zich bindt, helpt ons te voorspellen waarom bepaalde genetische variaties individuen en families die hen ertoe brengen vatbaar kunnen maken voor het ontwikkelen van diabetes. evenzo, door de regels te verduidelijken die SPOP gebruikt om de eiwitten te identificeren waaraan het moet binden en reguleren, we kunnen andere eiwitten die het reguleert beter voorspellen. We kunnen ook voorspellen hoe natuurlijk voorkomende variaties in hun aminozuursequenties de normale SPOP-binding kunnen verstoren, leidt tot slechte gezondheidsresultaten.
Usher:SPOP staat ook bekend om zijn rol bij bepaalde vormen van kanker, waaronder prostaat- en endometriumkanker. Hoewel buiten het bestek van ons huidige werk, beter definiëren hoe SPOP bindende partners selecteert, zal waarschijnlijk ook van invloed zijn op toekomstig onderzoek op dit gebied.
 Zonlicht kan worden gebruikt om verontreinigende stoffen in water uit te roeien
Zonlicht kan worden gebruikt om verontreinigende stoffen in water uit te roeien Nieuw verbeterd glasplaatje verandert microscopen in thermometers
Nieuw verbeterd glasplaatje verandert microscopen in thermometers Chemici bereiken doorbraak in de productie van driedimensionale moleculaire structuren
Chemici bereiken doorbraak in de productie van driedimensionale moleculaire structuren Onderzoek naar de complexe diëlektrische eigenschappen van metaal-organische raamwerken (MOF's)
Onderzoek naar de complexe diëlektrische eigenschappen van metaal-organische raamwerken (MOF's) Wetenschappers identificeren bioactieve stoffen in cacaobonen om medicijnen te ontwikkelen om skeletaandoeningen te bestrijden
Wetenschappers identificeren bioactieve stoffen in cacaobonen om medicijnen te ontwikkelen om skeletaandoeningen te bestrijden
Hoofdlijnen
- Sommige mariene soorten zijn kwetsbaarder voor klimaatverandering dan andere
- Onderzoeker onderzoekt de rol van kleine RNA's in communicatie tussen cellen
- Wat is late telofase?
- Waarom DNA de meest gunstige moleculen is voor genetisch materiaal en hoe RNA zich verhoudt tot deze Respect
- Onderzoek naar parasieten effent de weg voor infectietherapieën
- Hoe kan licht virussen doden?
- De geleidbaarheid van zenuwcellen in het centrale zenuwstelsel
- Een klassieke darwinistische ecologische hypothese houdt stand - met een twist
- Het grote structurele voordeel Eukaryoten hebben over prokaryoten
- Wiskundige modellering laat zien hoe chitinase, een moleculaire monorail, gehoorzaamt aan eenrichtingsverkeer
- Onderzoekers ontwikkelen nanoporeuze super-multi-elementenkatalysator

- Ultragevoelige transistor voor detectie van herbiciden in water

- Interactie tussen jodonium en zilverkation voor het eerst aangetoond
- Nieuwe biocompatibele hybride hydrogels met indrukwekkende mechanische eigenschappen

 14 biedingen komen naar voren voor getroffen Franse luchtvaartmaatschappij, maar niet haalbaar
14 biedingen komen naar voren voor getroffen Franse luchtvaartmaatschappij, maar niet haalbaar Wetenschap zegt:recordhitte, branden verergerd door klimaatverandering
Wetenschap zegt:recordhitte, branden verergerd door klimaatverandering Wetenschappers ontwarren nanobuisjes om hun potentieel in de elektronica-industrie vrij te maken (met video)
Wetenschappers ontwarren nanobuisjes om hun potentieel in de elektronica-industrie vrij te maken (met video) Uniek materiaal kan nieuwe functionaliteit in halfgeleiders ontsluiten
Uniek materiaal kan nieuwe functionaliteit in halfgeleiders ontsluiten Elektronenbundels houden ionen koel bij RHIC
Elektronenbundels houden ionen koel bij RHIC Geïnhaleerde nanodeeltjes leveren een krachtige cocktail tegen kanker aan longtumoren en blokkeren de weerstand
Geïnhaleerde nanodeeltjes leveren een krachtige cocktail tegen kanker aan longtumoren en blokkeren de weerstand Dodelijke crash roept vragen op over zelfrijdend Uber-systeem
Dodelijke crash roept vragen op over zelfrijdend Uber-systeem Bij de vulkaan van Guatemala, weer en gevaar stoppen zoeken
Bij de vulkaan van Guatemala, weer en gevaar stoppen zoeken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

