
Wetenschap
Anionen en oplosmiddelen sturen kiemvorming en groei van de vaste elektrolyt-interfase
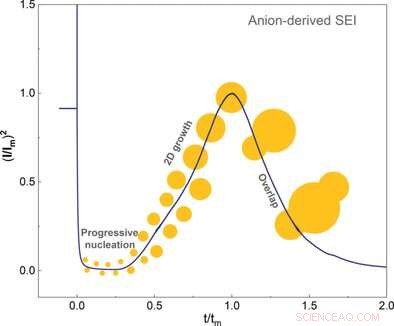
© Wiley-VCH. Krediet:Angewandte Chemie International Edition doi.org/10.1002/anie.202100494
Batterijen laden en laden op - blijkbaar allemaal dankzij een perfect samenspel van elektrodemateriaal en elektrolyt. Echter, voor een ideale batterijfunctie, de vaste elektrolyt interfase (SEI) speelt een cruciale rol. Materiaalwetenschappers hebben nu de kiemvorming en groei van deze laag tot in atomaire details bestudeerd. Volgens de studie gepubliceerd in het tijdschrift Angewandte Chemie , de eigenschappen van anionen en oplosmiddelmoleculen moeten goed in balans zijn.
In lithium-ionbatterijen, de SEI-formulieren aan het begin van het eerste laadproces, wanneer een potentiaal wordt toegepast. Elementen uit de elektrolyt zetten zich af op de grafietelektrode en vormen een coating die al snel de hele elektrode bedekt. Pas nadat deze laag is voltooid, kunnen de positieve lithiumionen intercaleren in de elektrode zonder het elektrodemateriaal te exfoliëren.
Qiang Zhang en collega's van de Tsinghua University, Peking, China, hebben nu de kiemvorming en groei van de SEI onder de loep genomen. De elektrolyt in lithium-ionbatterijen bevat lithiumzout en een oplosmiddel. Sterk oplossende oplosmiddelen omhullen het lithiumion, en de anionen drijven vrij rond. In tegenstelling tot, zwak solvaterende elektrolyten zorgen voor een nauwere hechting van de anionen aan het lithiumion. Hier, de anionen blijven deel uitmaken van de binnenste solvatatieschil.
Deze binnenste solvatatieschil moet van het lithium worden verwijderd om SEI-vorming en -groei mogelijk te maken. De onderzoekers toonden aan dat de anionen van de binnenste schil eerst adsorberen aan de verse elektrode en vervolgens twee elektronen opnemen in een elektrochemische reactie. Deze laatste gebeurtenis veroorzaakte ontbinding en nucleatie van de SEI. De auteurs concludeerden dat SEI-vorming voornamelijk afhing van hoe gemakkelijk de anionen elektronen kunnen grijpen en ontleden in vergelijking met het oplosmiddel.
De wetenschappers gebruikten elektrochemische technieken en atoomkrachtmicroscopie om de kristalgroei tot voltooiing van de laag te onderzoeken. Ze ontdekten dat er pas een gladde laag ontstond bij lage overpotentialen. Het oplosmiddel had ook invloed op de overpotentiaal. De auteurs merkten ook op dat oplosmiddelen met een hoge affiniteit voor de kristallijne laag helemaal geen overpotentiaal produceerden.
Ze concludeerden dat toekomstige ontwerpen van hoogwaardige elektroden zich meer zouden moeten richten op het samenspel tussen de negatieve ionen van het lithiumzout en het oplosmiddel. Om een homogeen anorganisch, kristallijne SEI te vormen, de anionen moeten het oplosmiddel overtreffen; ze zouden gemakkelijker aan het elektrodeoppervlak moeten adsorberen en elektrochemische reacties kunnen uitvoeren. In aanvulling, de ontledingsproducten moeten vast en onoplosbaar zijn, maar toch een zekere affiniteit met het oplosmiddel vertonen, zeiden de auteurs.
 NASA ziet tropische cycloon Olga samensmelten met een koufront
NASA ziet tropische cycloon Olga samensmelten met een koufront Naarmate het klimaat het Arctische zee-ijs sneller opschudt, vervuilingstags mee
Naarmate het klimaat het Arctische zee-ijs sneller opschudt, vervuilingstags mee Verbetering van de Chinese luchtvervuiling leidt tot zakelijke kansen
Verbetering van de Chinese luchtvervuiling leidt tot zakelijke kansen Gebouwd zand zuigt verontreinigende stoffen in het regenwater op
Gebouwd zand zuigt verontreinigende stoffen in het regenwater op Beschrijf een gebalanceerd ecosysteem
Beschrijf een gebalanceerd ecosysteem
Hoofdlijnen
- Gespecialiseerde cellen in het lichaam
- De rol van GTE in DNA-extractie
- Vissen gebruiken doofheidsgen om waterbeweging waar te nemen
- Krillgedrag brengt koolstof naar de diepten van de oceaan
- Human Heart Science Projects
- Wie eet wie? Hoe klimaatverandering de interacties tussen vissen en roofdieren verandert
- Het verschil tussen Anaphase, Interphase, Metaphase en Prophase
- Selenium zou de sleutel kunnen zijn tot het mysterie van kribbebijten bij paarden
- Gerst is de smaak van de maand, aangezien nieuwe studie het eeuwenoude brouwdebat beslecht
- Wetenschappers melden voor het eerst zware ionenoverdracht in geladen vdW-cluster

- Onderzoekers identificeren nieuw proces om ammoniak te produceren met een veel kleinere ecologische voetafdruk

- Vervuilers, ziekteverwekkers kunnen samenwerken om ons ziek te maken

- Onderzoeksteam ontdekt verloren afbeeldingen uit de 19e eeuw

- Leviathan-polymeerborstel gemaakt met E. coli houdt bacteriën op afstand

 Neurale netwerken onder de loep nemen
Neurale netwerken onder de loep nemen Een transformatieve metasurface op basis van een zerogap embedded template
Een transformatieve metasurface op basis van een zerogap embedded template Baanbrekend onderzoek vindt dat hyperspectrale beeldvorming de sterke punten van bouwmaterialen kan karakteriseren
Baanbrekend onderzoek vindt dat hyperspectrale beeldvorming de sterke punten van bouwmaterialen kan karakteriseren Wereldwijd bestuur moet de tijdgeest van wantrouwen overwinnen om de milieuproblemen van de wereld aan te pakken
Wereldwijd bestuur moet de tijdgeest van wantrouwen overwinnen om de milieuproblemen van de wereld aan te pakken Caps niet de boosdoener in chiraliteit van nanobuisjes
Caps niet de boosdoener in chiraliteit van nanobuisjes Polymeermicrodeeltjes kunnen helpen bij het verifiëren van goederen
Polymeermicrodeeltjes kunnen helpen bij het verifiëren van goederen IJs is een reddingslijn voor 's werelds koudste regio
IJs is een reddingslijn voor 's werelds koudste regio Hoe een baksteen te lezen Masons Liniaal
Hoe een baksteen te lezen Masons Liniaal
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com

