
Wetenschap
High-speed atomic force microscopie visualiseert celeiwitfabrieken
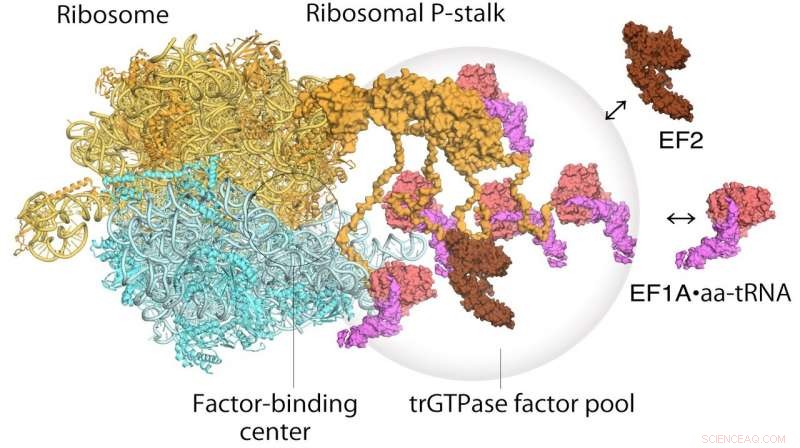
Model voor het vertalen van ribosomen en verlengingsfactoren. EF1A•GTP•aatRNA en EF2 assembleren tot de ribosomale stengel op het translerende ribosoom. De pool van translatiefactoren draagt bij aan een efficiënte eiwitsynthese in een overvolle intracellulaire omgeving. Credit: Proceedings van de National Academy of Sciences
Ribosomen zijn de complexen van ribonucleoproteïnen in het hart van de eiwitsynthese in cellen. Echter, bij gebrek aan sluitend bewijs, hoe deze complexen werken stond open voor discussie. Nutsvoorzieningen, Hirotatsu Imai en Noriyuki Kodera aan de Universiteit van Kanazawa, naast Toshio Uchiumi aan de Niigata University in Japan, laat visualisaties zien van de structurele dynamiek en factorpooling die plaatsvinden bij ribosoomsteeleiwitten terwijl ze nieuwe eiwitten bouwen.
Ribosomen werden voor het eerst ontdekt in de jaren vijftig, en hun brede functie wordt al enige tijd algemeen begrepen - ze lezen boodschapper-RNA-sequenties, en van daaruit het genereren van sequenties van correct geordende aminozuren tot nieuwe eiwitten. Vooral het ribosoomsteeleiwit speelt een integrale rol in het eiwitsyntheseproces door eiwitfactoren te rekruteren die verantwoordelijk zijn voor translatie en verlenging van de aminozuursequentie. Echter, het was moeilijk om de structuur van het gebonden ribosoomsteeleiwit vast te stellen vanwege zijn flexibiliteit. Hier, de hoge resolutie en snelle beeldopname van snelle atoomkrachtmicroscopie bleek van onschatbare waarde.
Atoomkrachtmicroscopie gebruikt een tip op nanoschaal om de monsters te traceren, net als de naald van een vinylplatenspeler die over een plaat scant, behalve dat de details die worden geïdentificeerd door een atoomkrachtmicroscoop een resolutie op atomaire schaal kunnen hebben. De veelzijdigheid van de techniek voor verschillende oppervlakken was al een enorm voordeel voor biologische studies, maar met de komst van snelle atoomkrachtmicroscopie, de techniek was in staat om voor het eerst dynamische processen vast te leggen, ook. Imai, Uchiumi en Kodera gebruikten de techniek om te onthullen dat het stengeleiwit eigenlijk tussen twee conformaties wisselt - een die overeenkomt met eerdere structurele modellen en een geheel onverwachte nieuwe conformatie.
Wat betreft hoe het ribosoom werkt, een tweestapsmechanisme was eerder voorgesteld om te beschrijven hoe genetische informatie wordt vertaald door eiwitten die bekend staan als translationele GTPase-factoren. De eerste stap is de rekrutering van de factoren naar de factor-tethering-site op de eiwitsteel, waardoor de concentratie van factoren daar toeneemt, de zogenaamde factorpooling. De tweede stap is de binding en stabilisatie van een translationeel GTPase op het ribosomale factor-bindingscentrum om GTPase-hydrolyse te katalyseren. Uit hun snelle atoomkrachtmicroscopiestudie, de onderzoekers waren in staat om het eerste visuele bewijs voor het translationele GTPase-factorpoolingsmechanisme door de ribosomale stengel te verkrijgen.
Hoewel de studie geen sluitend bewijs kon leveren van de werking van de factoren eenmaal gebonden, de onderzoekers merkten wel op dat de factoren in de buurt leken te blijven zodra de GTPase-hydrolyse voltooid was, suggereert een mogelijke rol van het stengeleiwit in verdere stadia van eiwitsynthese. De onderzoekers concluderen, "Toekomstig werk met HS-AFM zal verdere belangrijke informatie opleveren om het dynamische gedrag van deze complexe translationele machines te begrijpen."
 Produceren van F-18-radiofarmaca voor PET-beeldvorming
Produceren van F-18-radiofarmaca voor PET-beeldvorming Onderzoekers decoderen molecuul dat levende weefsels hun flexibiliteit geeft
Onderzoekers decoderen molecuul dat levende weefsels hun flexibiliteit geeft Een op rhodium gebaseerde katalysator voor het maken van organosilicium met minder edelmetaal
Een op rhodium gebaseerde katalysator voor het maken van organosilicium met minder edelmetaal Hoe AMU naar Mole
Hoe AMU naar Mole Big data identificeert lipiden als kenmerken van gezondheid en ziekte
Big data identificeert lipiden als kenmerken van gezondheid en ziekte
 Coronavirus:waarom we een einde moeten maken aan het pandemische verbod op herbruikbare bekers
Coronavirus:waarom we een einde moeten maken aan het pandemische verbod op herbruikbare bekers 70% van de Amerikanen praat zelden over de milieu-impact van hun voedsel
70% van de Amerikanen praat zelden over de milieu-impact van hun voedsel Kustwetlands zijn natuurlijke waterkeringen
Kustwetlands zijn natuurlijke waterkeringen UITLEG:Wat de geschiedenis van Kilaueas ons vertelt over zijn toekomst?
UITLEG:Wat de geschiedenis van Kilaueas ons vertelt over zijn toekomst? Onderzoek toont aan dat de Clean Air Act waarschijnlijk verantwoordelijk is voor de dramatische afname van atmosferische organische aerosol
Onderzoek toont aan dat de Clean Air Act waarschijnlijk verantwoordelijk is voor de dramatische afname van atmosferische organische aerosol
Hoofdlijnen
- De wetenschap achter waarom sommige mensen van dieren houden en anderen niets kan schelen
- Hoe werkt hennep?
- 5 waargebeurde verhalen over een bij de geboorte gescheiden tweeling
- Gemengde organisatie van darmbacteriën wordt onthuld door microbioombeeldvormingstechnologie
- Vrouwelijke vissen houden van zingende mannetjes
- De vergeten wetenschapper die de weg vrijmaakte voor de ontdekking van de DNA-structuur
- Welke stadia zijn er in de mitochondriën?
- Domme mensen zijn verrassend zelfverzekerd
- Waarom herinneren we ons pijn?
- Wetenschappers vinden krachtig potentieel wapen om antibioticaresistentie te overwinnen
- Een gestroomlijnde benadering voor het bepalen van thermische eigenschappen van kristallijne vaste stoffen en legeringen

- Onderzoekers ontdekken de kunst van het feilloos printen van extreem harde staalsoorten
- Onbreekbaar glas geïnspireerd op schelpen
- Veilig printen met onzichtbare inkt op waterbasis

 Hoe het negatieve over een elektrisch snoer te vertellen
Hoe het negatieve over een elektrisch snoer te vertellen  Impact van schaliegas genegeerd in Engeland, nieuwe studie vondsten
Impact van schaliegas genegeerd in Engeland, nieuwe studie vondsten Poolse dagbladen drukken blanco voorpagina in beroep op EU-auteursrecht
Poolse dagbladen drukken blanco voorpagina in beroep op EU-auteursrecht Media, non-profitorganisaties die klimaatverandering in kaart brengen, beïnvloedt hoe mensen over problemen denken, onderzoeken tonen aan
Media, non-profitorganisaties die klimaatverandering in kaart brengen, beïnvloedt hoe mensen over problemen denken, onderzoeken tonen aan Hoe een tipi maken van PVC pijp
Hoe een tipi maken van PVC pijp  De uraniummijn in het hart van Kakadu heeft een beter opruimplan nodig
De uraniummijn in het hart van Kakadu heeft een beter opruimplan nodig Ernest Everett Just
Ernest Everett Just  Industriële microben kunnen vee voeden, varkens en kippen met minder schade aan het milieu
Industriële microben kunnen vee voeden, varkens en kippen met minder schade aan het milieu
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

