
Wetenschap
Wetenschappers identificeren chemische oorzaken van vervaging van batterijcapaciteit
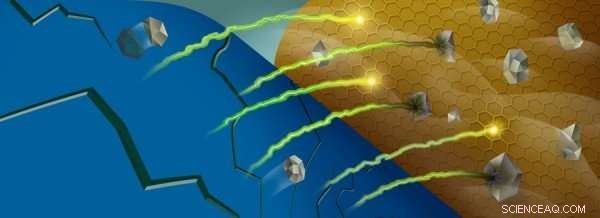
Wanneer mangaanionen (grijs) uit de kathode van een batterij (blauw) worden gestript, ze kunnen reageren met het elektrolyt van de batterij in de buurt van de anode (goud), het vangen van lithiumionen (groen/geel). Krediet:Robert Horn/Argonne National Laboratory
Zoals jij, ik en iedereen die we kennen, batterijen hebben een beperkte levensduur.
Wanneer een batterij "ouderdom" wordt, " wetenschappers verwijzen naar de verminderde prestaties als "capaciteit vervagen, " waarbij de hoeveelheid lading die een batterij kan leveren afneemt bij herhaald gebruik. Capaciteitsvervaging is de reden waarom een batterij van een mobiele telefoon die vroeger een hele dag meeging, dat doet, na een paar jaar, duren misschien maar een paar uur.
Maar wat als wetenschappers deze capaciteitsvervaging zouden kunnen verminderen, batterijen mooier laten verouderen?
"Nu we de mechanismen kennen achter het opsluiten van lithiumionen en de capaciteit vervagen, we kunnen methoden vinden om het probleem op te lossen."
Onderzoekers van het Argonne National Laboratory van het Amerikaanse Department of Energy (DOE) identificeerden een van de belangrijkste boosdoeners in de capaciteitsvermindering van hoogenergetische lithium-ionbatterijen in een paper gepubliceerd in The Journal of the Electrochemical Society.
Voor een lithium-ionbatterij - het soort dat we in laptops gebruiken, smartphones, en plug-in hybride elektrische voertuigen - de capaciteit van de batterij is rechtstreeks gekoppeld aan de hoeveelheid lithiumionen die heen en weer kan worden gependeld tussen de twee terminals van de batterij terwijl deze wordt opgeladen en ontladen.
Dit pendelen wordt mogelijk gemaakt door bepaalde overgangsmetaalionen, die oxidatietoestanden veranderen als lithiumionen in en uit de kathode bewegen. Echter, terwijl de batterij wordt gefietst, sommige van deze ionen, met name mangaan, worden uit het kathodemateriaal gestript en komen terecht bij de anode van de batterij.
Eenmaal in de buurt van de anode, deze metaalionen interageren met een gebied van de batterij dat de vaste-elektrolyt-interfase wordt genoemd, die ontstaat door reacties tussen de zeer reactieve anode en de vloeibare elektrolyt die de lithiumionen heen en weer vervoert. Voor elk elektrolytmolecuul dat reageert en ontleedt in een proces dat reductie wordt genoemd, een lithiumion wordt gevangen in de interfase. Naarmate meer en meer lithium vast komt te zitten, de capaciteit van de batterij neemt af.
Sommige moleculen in deze interfase zijn onvolledig gereduceerd, wat betekent dat ze meer elektronen kunnen opnemen en nog meer lithiumionen kunnen binden. Deze moleculen zijn als tondel, wachtend op een vonk.
Wanneer de mangaanionen in deze interfase worden afgezet, werken ze als een vonk die de tondel ontsteekt:deze ionen zijn efficiënt in het katalyseren van reacties met de onvolledig gereduceerde moleculen, het vangen van meer lithiumionen in het proces.
"Er is een strikte correlatie tussen de hoeveelheid mangaan die zijn weg vindt naar de anode en de hoeveelheid lithium die vast komt te zitten, " zei co-auteur van de studie en Argonne-wetenschapper Daniel Abraham. "Nu we de mechanismen kennen achter het opsluiten van lithiumionen en de capaciteit vervagen, we kunnen methoden vinden om het probleem op te lossen."
 Wijdverbreide uitdroging van Europese veengebieden in de afgelopen eeuwen
Wijdverbreide uitdroging van Europese veengebieden in de afgelopen eeuwen Wormen kunnen rijststro verwerken, wetenschappers ontdekken
Wormen kunnen rijststro verwerken, wetenschappers ontdekken A-74 ijsberg bijna botsing met Brunt Ice Shelf
A-74 ijsberg bijna botsing met Brunt Ice Shelf Een kraan bouwen voor een schoolproject
Een kraan bouwen voor een schoolproject Nieuw onderzoek onthult geografische processen achter verbijsterende rivierlagen
Nieuw onderzoek onthult geografische processen achter verbijsterende rivierlagen
Hoofdlijnen
- Hoe de dalingssnelheid te berekenen
- De effecten van algen in drinkwater
- Neteldieren controleren bacteriën op afstand
- Misplaatste monarchen:clusters van vlinders in het noorden
- De nadelen van gelelektroforese
- Albatrospopulaties nemen af door visserij en veranderingen in het milieu
- Wetenschappers roepen de VS op om onderzoek naar potmedicijnen voor huisdieren toe te staan
- Wat is een Micel in Biochemie?
- Nieuwe bevindingen verduidelijken de rol van de schildklier bij seizoensveranderingen bij zoogdieren
- nieuwe efficiënte, lage-temperatuurkatalysator voor waterstofproductie

- Magnetrons tegen koude start-emissies

- Een eenvoudige methode ontwikkeld voor 3D-biofabricage op basis van bacteriële cellulose

- Nieuw polymeer geïnspireerd op kristallijn silicium om betere computers en zonnecellen te bouwen
- Afvalproduct van oliehoudende gewassen levert verbindingen op die de huid beschermen tegen de zon

 Gist brengt genetische variaties in de schijnwerpers die verband houden met resistentie tegen geneesmiddelen
Gist brengt genetische variaties in de schijnwerpers die verband houden met resistentie tegen geneesmiddelen Duinen gevangen in een krater op Mars vormen dit interessante patroon
Duinen gevangen in een krater op Mars vormen dit interessante patroon Hoe beïnvloedt het klimaat het ecosysteem van het regenwoud?
Hoe beïnvloedt het klimaat het ecosysteem van het regenwoud?  Kaartschalen
Kaartschalen Wat gebeurt er wanneer glucose een cel binnengaat?
Wat gebeurt er wanneer glucose een cel binnengaat?  Voordelen en nadelen van AC-generatoren
Voordelen en nadelen van AC-generatoren Zeldzame witte tijger met kanker sterft in dierentuin
Zeldzame witte tijger met kanker sterft in dierentuin Epitheliale cellen: definitie, functie, typen en voorbeelden
Epitheliale cellen: definitie, functie, typen en voorbeelden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

