
Wetenschap
2 wetenschappers winnen Nobelprijs voor scheikunde voor tool voor genbewerking

Op deze 14 maart 2016 bestandsfoto Amerikaanse biochemicus Jennifer A. Doudna, links, en de Franse microbioloog Emmanuelle Charpentier, Rechtsaf, poseert voor een foto in Frankfurt, Duitsland. De Franse wetenschapper Emmanuelle Charpentier en de Amerikaanse Jennifer A. Doudna hebben de Nobelprijs voor scheikunde 2020 gewonnen voor het ontwikkelen van een methode van genoombewerking die wordt vergeleken met 'moleculaire schaar' en die de belofte biedt dat genetische ziekten op een dag zullen genezen. (Alexander Heinl/dpa via AP)
De Nobelprijs voor scheikunde ging woensdag naar twee onderzoekers voor een hulpmiddel voor het bewerken van genen dat een revolutie teweeg heeft gebracht in de wetenschap door een manier te bieden om DNA te veranderen. de code van het leven - technologie die al wordt gebruikt om te proberen een groot aantal ziekten te genezen en betere gewassen en vee te fokken.
Emmanuelle Charpentier uit Frankrijk en Jennifer A. Doudna uit de Verenigde Staten wonnen voor de ontwikkeling van CRISPR-cas9, een heel eenvoudige techniek om een gen op een bepaalde plek te knippen, waardoor wetenschappers kunnen werken aan gebreken die de oorzaak zijn van veel ziekten.
"Er zit een enorme kracht in dit genetische hulpmiddel, " zei Claes Gustafsson, voorzitter van het Nobelcomité voor Scheikunde.
Er zijn meer dan 100 klinische onderzoeken gaande om het gebruik van CRISPR voor de behandeling van ziekten, en "velen zijn veelbelovend, " volgens Victor Dzau, voorzitter van de National Academy of Medicine.
"Mijn grootste hoop is dat het voor goed wordt gebruikt, om nieuwe mysteries in de biologie te ontdekken en de mensheid ten goede te komen, " zei Doudna, die is verbonden aan de Universiteit van Californië, Berkeley, en wordt betaald door het Howard Hughes Medical Institute, die ook de gezondheids- en wetenschapsafdeling van The Associated Press ondersteunt.
Het prijswinnende werk heeft de deur geopend voor een aantal netelige ethische kwesties:wanneer het bewerken na de geboorte wordt gedaan, de wijzigingen zijn beperkt tot die persoon. Wetenschappers vrezen dat CRISPR zal worden misbruikt om 'designerbaby's' te maken door eieren te veranderen, embryo's of sperma - veranderingen die kunnen worden doorgegeven aan toekomstige generaties.
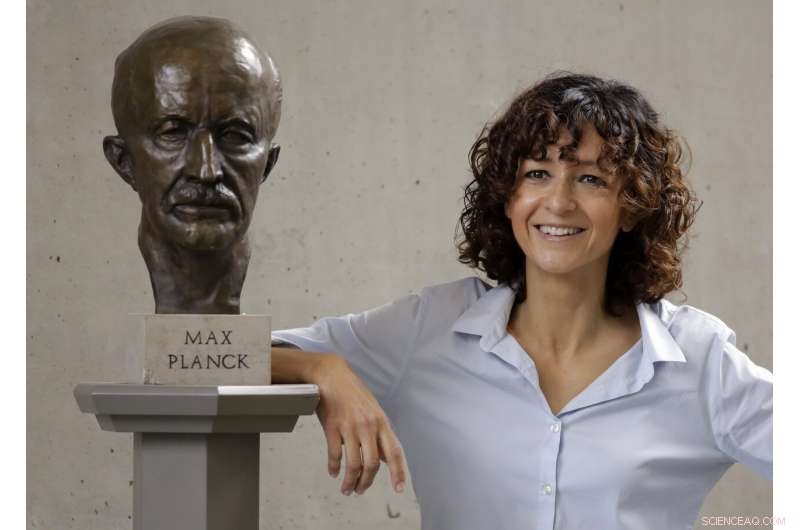
Franse microbioloog Emmanuelle Charpentier poseert bij een standbeeld van Max Planck in Berlijn, Duitsland, Woensdag, 7 okt. 2020. De Franse wetenschapper Emmanuelle Charpentier en de Amerikaanse Jennifer A. Doudna hebben de Nobelprijs voor scheikunde 2020 gewonnen voor het ontwikkelen van een methode van genoombewerking die wordt vergeleken met een 'moleculaire schaar' en die de belofte biedt om op een dag genetische ziekten te genezen. (AP Foto/Markus Schreiber)
Een groot deel van de wereld werd zich in 2018 bewust van CRISPR, toen de Chinese wetenschapper He Jiankui onthulde dat hij had geholpen bij het maken van 's werelds eerste gen-bewerkte baby's, om te proberen weerstand te ontwikkelen tegen infectie met het aids-virus. Zijn werk werd afgedaan als onveilige menselijke experimenten, en hij is veroordeeld tot gevangenisstraf in China.
In september, een internationaal panel van experts heeft een rapport uitgebracht waarin staat dat het te vroeg is om dergelijke experimenten uit te proberen, omdat de wetenschap niet geavanceerd genoeg is om de veiligheid te garanderen.
"Als je genen selectief kunt bewerken, betekent dit dat je op een bepaalde manier voor God speelt, ", zei Luis Echegoyen, voorzitter van de American Chemical Society, een scheikundeprofessor aan de Universiteit van Texas El Paso.
Dr. George Daley, decaan van de Harvard Medical School, zei:"Nieuwe technologie presenteert vaak deze dichotomie - er is een enorm potentieel voor menselijk voordeel, vooral voor de behandeling van ziekten, maar ook het risico van een verkeerde toepassing."

Franse microbioloog Emmanuelle Charpentier praat met mediamensen in Berlijn, Duitsland, Woensdag, 7 okt. 2020. De Franse wetenschapper Emmanuelle Charpentier en de Amerikaanse Jennifer A. Doudna hebben de Nobelprijs voor scheikunde 2020 gewonnen voor het ontwikkelen van een methode van genoombewerking die wordt vergeleken met een 'moleculaire schaar' en die de belofte biedt om op een dag genetische ziekten te genezen. (AP Foto/Markus Schreiber)
Echter, wetenschappers prezen alom het grote potentieel dat genbewerking nu voor patiënten heeft.
"Er is geen aspect van biomedisch onderzoek dat niet is aangeraakt door CRISPR, " die is gebruikt om betere gewassen te ontwikkelen en om te proberen menselijke ziekten te genezen, waaronder sikkelcelziekte, HIV-infectie en erfelijke vormen van blindheid, zei dr. Kiran Musunuru, een genetica-expert aan de Universiteit van Pennsylvania die onderzoek doet naar hartaandoeningen.
Doudna zei dat CRISPR ook het potentieel heeft om planten te ontwerpen om meer koolstof op te slaan of om extreme klimaatverandering te weerstaan, onderzoekers een kans geven om 'dringende problemen waarmee de mensheid wordt geconfronteerd aan te pakken'.
Het is de vierde keer in de 119-jarige geschiedenis van de prijzen dat een Nobelprijs voor de wetenschappen exclusief aan vrouwen wordt toegekend.
Charpentier, de 51-jarige leider van de Max Planck Unit for the Science of Pathogens in Berlijn, zei dat hoewel ze zichzelf in de eerste plaats een wetenschapper beschouwt, "Het weerspiegelt het feit dat de wetenschap moderner wordt en er meer vrouwelijke leiders bij betrokken zijn."

Op deze 19 mei Archieffoto uit 2015 Franse microbioloog Emmanuelle Charpentier poseert voor een foto in Brunswick, Duitsland. De Franse wetenschapper Emmanuelle Charpentier en de Amerikaanse Jennifer A. Doudna hebben de Nobelprijs voor scheikunde 2020 gewonnen voor het ontwikkelen van een methode van genoombewerking die wordt vergeleken met 'moleculaire schaar' en die de belofte biedt dat genetische ziekten op een dag zullen genezen. (Peter Steffen/dpa via AP)
"Ik hoop echt dat het in deze richting zal blijven en zich zelfs meer zal ontwikkelen, " ze zei, eraan toevoegend dat het "omslachtiger is om een vrouw in de wetenschap te zijn dan om een man in de wetenschap te zijn."
Drie keer heeft een vrouw in haar eentje een Nobelprijs voor de wetenschappen gewonnen; dit is de eerste keer dat een volledig vrouwelijk team een wetenschapsprijs wint. 1911, Marie Curie was de enige ontvanger van de scheikundeprijs, net als Dorothy Crowfoot Hodgkin in 1964. In 1983, Barbara McClintock won de Nobelprijs voor de geneeskunde.
Het baanbrekende onderzoek van Charpentier en Doudna verscheen in 2012 waardoor de ontdekking zeer recent is vergeleken met veel ander Nobel-winnend onderzoek, die vaak pas na tientallen jaren wordt geëerd.
Dr. Francis Collins, die de aanzet gaf om het menselijk genoom in kaart te brengen, zei dat de technologie "alles heeft veranderd" over hoe ziekten met een genetische oorzaak kunnen worden benaderd.

Op deze 14 maart 2016 bestandsfoto Franse microbioloog Emmanuelle Charpentier poseert voor een foto in Frankfurt, Duitsland. De Franse wetenschapper Emmanuelle Charpentier en de Amerikaanse Jennifer A. Doudna hebben de Nobelprijs voor scheikunde 2020 gewonnen voor het ontwikkelen van een methode van genoombewerking die wordt vergeleken met 'moleculaire schaar' en die de belofte biedt dat genetische ziekten op een dag zullen genezen. (Alexander Heinl/dpa via AP)
"Je kunt een directe lijn trekken van het succes van het menselijk genoomproject naar de kracht van CRISPR-cas om wijzigingen aan te brengen in het instructieboek, " zei Collins, directeur van de Amerikaanse National Institutes of Health, die hielpen Doudna's werk te financieren.
Het brede instituut, gezamenlijk gerund door Harvard en MIT, heeft in een rechtszaak gevochten met de Nobelprijswinnaars over patenten op CRISPR-technologie, en vele andere wetenschappers hebben er belangrijk werk aan verricht, maar Doudna en Charpentier zijn het meest consequent geëerd met prijzen omdat ze er een gemakkelijk bruikbaar hulpmiddel van hebben gemaakt.
Feng Zhang, de brede wetenschapper die het meest bekend is om dat werk, gaf geen commentaar op de onderscheidingen, maar de directeur van Broad, Erik Lander, heeft via Twitter de winnaars gefeliciteerd. Een andere brede wetenschapper op het gebied van genbewerking, David Liu, merkte op Twitter op dat de baanbrekende onderzoekspaper van de winnaars in 2012 meer dan 9 is geciteerd 500 keer, of ongeveer eens in de acht uur.
-

Deze dinsdag, 1 december Bestandscombo-afbeelding uit 2015 toont Emmanuelle Charpentier, links, en Jennifer Doudna, beiden spreken op de internationale top van de National Academy of Sciences over de veiligheid en ethiek van menselijke genetische modificatie, in Washington. De Nobelprijs voor scheikunde 2020 is toegekend aan Emmanuelle Charpentier en Jennifer Doudna "voor de ontwikkeling van een methode voor genome editing." Een panel van de Zweedse Academie van Wetenschappen in Stockholm maakte de aankondiging woensdag 7 oktober, 2020. (AP Foto/Susan Walsh, Bestand)
-

Op deze 14 maart 2016 bestandsfoto Amerikaanse biochemicus Jennifer A. Doudna poseert voor een foto in Frankfurt, Duitsland. De Franse wetenschapper Emmanuelle Charpentier en de Amerikaanse Jennifer A. Doudna hebben de Nobelprijs voor scheikunde 2020 gewonnen voor het ontwikkelen van een methode van genoombewerking die wordt vergeleken met 'moleculaire schaar' en die de belofte biedt dat genetische ziekten op een dag zullen genezen. (Alexander Heinl/dpa via AP)
-

In deze 1 december 2015, bestand foto, Jennifer Doudna, een universiteit van Californië, Berkeley, mede-uitvinder van de CRISPR-tool voor het bewerken van genen die He Jiankui gebruikte, spreekt op de internationale top van de National Academy of Sciences over de veiligheid en ethiek van het bewerken van menselijke genen, in Washington. De Nobelprijs voor scheikunde 2020 is toegekend aan Emmanuelle Charpentier en Jennifer Doudna "voor de ontwikkeling van een methode voor genome editing." Een panel van de Zweedse Academie van Wetenschappen in Stockholm maakte de aankondiging woensdag 7 oktober, 2020. (AP Foto/Susan Walsh, Bestand)
-

Professor Pernilla Wittung Stafshede, links, en Goran K. Hansson, Secretaris-Generaal van de Academie van Wetenschappen, na de bekendmaking van de winnaars van de Nobelprijs voor Scheikunde 2020 tijdens een persconferentie in de Koninklijke Zweedse Academie van Wetenschappen, in Stockholm, Zweden, woensdag 7 okt. 2020. De Nobelprijs voor scheikunde 2020 is toegekend aan Emmanuelle Charpentier, links op het scherm, en Jennifer Doudna "voor de ontwikkeling van een methode voor genome editing." (Henrik Montgomery/TT via AP)
De Nobel wordt geleverd met een gouden medaille en 10 miljoen kronen (meer dan $ 1,1 miljoen), met dank aan een legaat dat meer dan een eeuw geleden is achtergelaten door de maker van de prijs, Alfred nobel, de uitvinder van dynamiet.
Op maandag, de Nobelprijs voor de geneeskunde werd toegekend voor de ontdekking van het leververwoestende hepatitis C-virus. De prijs van dinsdag in de natuurkunde eerde doorbraken in het begrijpen van zwarte gaten. De prijzen in de literatuur, vrede en economie zullen de komende dagen worden uitgereikt.
De aankondiging van de Nobel Foundation:
De Koninklijke Zweedse Academie van Wetenschappen heeft besloten om de Nobelprijs voor Scheikunde 2020 toe te kennen aan:
Emmanuelle Charpentier
Max Planck-eenheid voor de wetenschap van pathogenen, Berlijn, Duitsland
Jennifer A. Doudna
Universiteit van Californië, Berkeley, VS
"voor de ontwikkeling van een methode voor genome editing"
Genetische schaar:een hulpmiddel om de code van het leven te herschrijven
Emmanuelle Charpentier en Jennifer A. Doudna hebben een van de scherpste instrumenten van de gentechnologie ontdekt:de genetische schaar CRISPR/Cas9. Met behulp van deze, onderzoekers kunnen het DNA van dieren veranderen, planten en micro-organismen met extreem hoge precisie. Deze technologie heeft een revolutionaire impact gehad op de levenswetenschappen, draagt bij aan nieuwe kankertherapieën en kan de droom om erfelijke ziekten te genezen mogelijk maken.
Onderzoekers moeten genen in cellen aanpassen om meer te weten te komen over de innerlijke werking van het leven. Vroeger was dit tijdrovend, moeilijk en soms onmogelijk werk. Met behulp van de CRISPR/Cas9 genetische schaar, het is nu mogelijk om de code van het leven in de loop van een paar weken te veranderen.
"Er zit een enorme kracht in dit genetische hulpmiddel, die ons allemaal raakt. Het heeft niet alleen een revolutie teweeggebracht in de basiswetenschap, maar heeft ook geleid tot innovatieve gewassen en zal leiden tot baanbrekende nieuwe medische behandelingen, " zegt Claes Gustafsson, voorzitter van het Nobelcomité voor Scheikunde.
Zoals zo vaak in de wetenschap, de ontdekking van deze genetische scharen was onverwacht. Tijdens Emmanuelle Charpentier's studies van Streptococcus pyogenes, een van de bacteriën die de meeste schade aanrichten aan de mensheid, ontdekte ze een voorheen onbekende molecule, tracrRNA. Haar werk toonde aan dat tracrRNA deel uitmaakt van het oude immuunsysteem van bacteriën, CRISPR/Cas, dat virussen ontwapent door hun DNA te splitsen.
Charpentier publiceerde haar ontdekking in 2011. Datzelfde jaar startte ze een samenwerking met Jennifer Doudna, een ervaren biochemicus met uitgebreide kennis van RNA. Samen, ze slaagden erin de genetische schaar van de bacterie in een reageerbuis te recreëren en de moleculaire componenten van de schaar te vereenvoudigen, zodat ze gemakkelijker te gebruiken waren.
In een baanbrekend experiment, ze hebben vervolgens de genetische schaar opnieuw geprogrammeerd. In hun natuurlijke vorm, de schaar herkent DNA van virussen, maar Charpentier en Doudna hebben bewezen dat ze kunnen worden gecontroleerd, zodat ze elk DNA-molecuul op een vooraf bepaalde plaats kunnen knippen. Waar het DNA wordt geknipt, is het gemakkelijk om de code van het leven te herschrijven.
Sinds Charpentier en Doudna de genetische schaar CRISPR/Cas9 in 2012 ontdekten, is hun gebruik explosief gestegen. Deze tool heeft bijgedragen aan veel belangrijke ontdekkingen in fundamenteel onderzoek, en plantenonderzoekers hebben gewassen kunnen ontwikkelen die bestand zijn tegen schimmels, ongedierte en droogte. in de geneeskunde, klinische proeven van nieuwe kankertherapieën zijn aan de gang, en de droom om erfelijke ziekten te kunnen genezen staat op het punt in vervulling te gaan. Deze genetische scharen hebben de levenswetenschappen naar een nieuw tijdperk gebracht en, op veel manieren, brengen de mensheid het meeste voordeel.
**************************
Een van de aantrekkingskrachten van wetenschap is dat ze onvoorspelbaar is:je weet nooit van tevoren waar een idee of een vraag toe leidt. Soms loopt een nieuwsgierige geest dood, soms zal het een netelig labyrint tegenkomen dat jaren duurt om te navigeren. Maar, nu en opnieuw, ze realiseert zich dat ze de eerste persoon is die ooit naar een horizon van ongekende mogelijkheden kijkt.
De gen-editor genaamd CRISPR-Cas9 is zo'n onverwachte ontdekking met een adembenemend potentieel. Toen Emmanuelle Charpentier en Jennifer Doudna het immuunsysteem van een Streptococcus-bacterie begonnen te onderzoeken, een idee was dat ze misschien een nieuwe vorm van antibioticum zouden kunnen ontwikkelen. In plaats daarvan, ontdekten ze een moleculair hulpmiddel dat kan worden gebruikt om precieze incisies te maken in genetisch materiaal, waardoor het mogelijk is om de code van het leven gemakkelijk te veranderen.
Een krachtig hulpmiddel dat iedereen raakt
Slechts acht jaar na hun ontdekking, deze genetische scharen hebben de levenswetenschappen opnieuw vormgegeven. Biochemici en celbiologen kunnen nu gemakkelijk de functies van verschillende genen en hun mogelijke rol in de progressie van ziekte onderzoeken. Bij plantenveredeling is onderzoekers kunnen planten specifieke eigenschappen geven, zoals het vermogen om droogte in een warmer klimaat te weerstaan. in de geneeskunde, deze gen-editor draagt bij aan nieuwe kankertherapieën en de eerste onderzoeken die proberen erfelijke ziekten te genezen.
Er zijn bijna eindeloze voorbeelden van hoe CRISPR-Cas9 kan worden gebruikt, die ook onethische toepassingen omvatten. Zoals met alle krachtige technologie, deze genetische scharen moeten worden gereguleerd. Daarover later meer.
In 2011, noch Emmanuelle Charpentier noch Jennifer Doudna hadden enig idee dat hun eerste ontmoeting, in een café in Puerto Rico, was een levensveranderende ontmoeting. We beginnen met Charpentier, die aanvankelijk hun samenwerking voorstelden.
Charpentier is gefascineerd door pathogene bacteriën
Sommige mensen hebben haar gedreven genoemd, attent en grondig. Anderen zeggen dat Emmanuelle Charpentier altijd op zoek is naar het onverwachte. Haarzelf, ze citeert Louis Pasteur, "Het toeval is in het voordeel van de voorbereide geest". De drang om nieuwe ontdekkingen te doen en de wens om vrij en onafhankelijk te zijn hebben haar pad bepaald. Waaronder haar doctoraatsstudies aan het Institut Pasteur in Parijs, ze heeft in vijf verschillende landen gewoond, zeven verschillende steden en werkte bij tien verschillende instellingen.
Haar omgeving en benaderingen zijn veranderd, maar het grootste deel van haar onderzoek heeft één gemeenschappelijke noemer:pathogene bacteriën. Waarom zijn ze zo agressief? Hoe ontwikkelen ze hun resistentie tegen antibiotica? En is het mogelijk om nieuwe behandelingen te vinden die hun vooruitgang kunnen stoppen?
In 2002, toen Emmanuelle Charpentier haar eigen onderzoeksgroep begon aan de Universiteit van Wenen, ze concentreerde zich op een van de bacteriën die de mensheid de grootste schade toebrengen:Streptococcus pyogenes. Elk jaar, het infecteert miljoenen mensen, veroorzaakt vaak gemakkelijk behandelbare infecties zoals tonsillitis en impetigo. Echter, het kan ook levensbedreigende sepsis veroorzaken en de zachte weefsels in het lichaam afbreken, waardoor het een reputatie heeft als een 'vleeseter'.
Om S. pyogenes beter te begrijpen, Charpentier begon met grondig te onderzoeken hoe de genen van deze bacterie worden gereguleerd. Deze beslissing was de eerste stap op weg naar de ontdekking van de genetische schaar – maar voordat we verder langs die weg lopen, we zullen meer te weten komen over Jennifer Doudna. Want terwijl Charpentier gedetailleerde studies maakt van S. pyogenes, Doudna hoort – voor het eerst – een afkorting die volgens haar scherper klinkt.
Wetenschap – evenveel avontuur als een detectiveverhaal
Zelfs als kind dat opgroeide op Hawaï, Jennifer Doudna had een sterke drang om dingen te weten. Op een dag, haar vader legde James Watsons boek The Double Helix op haar bed. Dit verhaal in detectivestijl over hoe James Watson en Francis Crick de structuur van het DNA-molecuul hebben opgelost, leek op niets dat ze in haar schoolboeken had gelezen. Ze was gefascineerd door het wetenschappelijke proces en realiseerde zich dat wetenschap meer is dan alleen feiten.
Echter, toen ze wetenschappelijke mysteries begon op te lossen, haar aandacht was niet op DNA gericht, maar op zijn moleculaire broer of zus:RNA. In 2006 – als we haar ontmoeten – leidt ze een onderzoeksgroep aan de University of California, Berkeley, en heeft twee decennia ervaring in het werken met RNA. Ze staat bekend als succesvol onderzoeker met een neus voor grensverleggende projecten, en heeft onlangs een opwindend nieuw veld betreden:RNA-interferentie.
Voor vele jaren, onderzoekers hadden geloofd dat ze de basisfunctie van RNA begrepen, maar ze ontdekten plotseling veel kleine RNA-moleculen die helpen bij het reguleren van genactiviteit in cellen. Jennifer Doudna's betrokkenheid bij RNA-interferentie is de reden waarom, in 2006, ze krijgt een telefoontje van een collega van een andere afdeling.
Bacteriën dragen een oud immuunsysteem met zich mee
Haar collega, wie is microbioloog, vertelt Doudna over een nieuwe ontdekking:wanneer onderzoekers het genetisch materiaal van enorm verschillende bacteriën vergelijken, evenals archaea (een soort micro-organisme), ze vinden repetitieve DNA-sequenties die verrassend goed bewaard zijn gebleven. Dezelfde code verschijnt keer op keer, maar tussen de herhalingen zijn er unieke sequenties die verschillen. Het is alsof hetzelfde woord wordt herhaald tussen elke unieke zin in een boek.
Deze reeksen van herhaalde sequenties worden geclusterde, regelmatig op afstand staande korte palindroomherhalingen genoemd, afgekort als CRISPR. Het interessante is dat de unieke, niet-repetitieve sequenties in CRISPR lijken overeen te komen met de genetische code van verschillende virussen, dus de huidige gedachte is dat dit een onderdeel is van een oud immuunsysteem dat bacteriën en archaea beschermt tegen virussen. De hypothese is dat als een bacterie erin is geslaagd een virusinfectie te overleven, het voegt een stukje van de genetische code van het virus toe aan zijn genoom als herinnering aan de infectie.
Niemand weet nog hoe dit allemaal werkt, zegt haar collega maar het vermoeden is dat het mechanisme dat bacteriën gebruiken om een virus te neutraliseren vergelijkbaar is met het mechanisme dat Doudna heeft bestudeerd:RNA-interferentie.
Doudna brengt een complexe machine in kaart
Dit nieuws is zowel opmerkelijk als opwindend. Als het waar is dat bacteriën een oud immuunsysteem hebben, dan is dit een groot probleem. Jennifer Doudna's gevoel voor moleculaire intriges komt tot leven en ze begint alles te leren over het CRISPR-systeem.
Het blijkt dat, naast de CRISPR-sequenties, onderzoekers hebben speciale genen ontdekt die ze CRISPR-geassocieerd hebben genoemd, afgekort als ca. Wat Doudna interessant vindt, is dat deze genen erg lijken op genen die coderen voor reeds bekende eiwitten die gespecialiseerd zijn in het afwikkelen en opknippen van DNA. Hebben de Cas-eiwitten dus dezelfde functie? Splitsen ze virus-DNA?
Ze zet haar onderzoeksgroep aan het werk en, na een aantal jaar, ze zijn erin geslaagd de functie van verschillende Cas-eiwitten te onthullen. parallel, een handvol andere onderzoeksgroepen van andere universiteiten bestuderen het nieuw ontdekte CRISPR/Cas-systeem. Hun mapping laat zien dat het immuunsysteem van bacteriën heel verschillende vormen kan aannemen. Het door Doudna bestudeerde CRISPR/Cas-systeem behoort tot klasse 1; het is een complexe machine die veel verschillende Cas-eiwitten nodig heeft om een virus te ontwapenen. De klasse 2-systemen zijn aanzienlijk eenvoudiger omdat ze minder eiwitten nodig hebben. In een ander deel van de wereld, Emmanuelle Charpentier is zojuist zo'n systeem tegengekomen. Terug naar haar.
Een nieuw en onbekend stukje van de CRISPR-systeempuzzel
Toen we Emmanuelle Charpentier verlieten, woonde ze in Wenen, maar in 2009 verhuisde ze naar een functie met goede onderzoeksmogelijkheden aan de universiteit van Umeå in het noorden van Zweden. Ze was gewaarschuwd om naar zo'n afgelegen deel van de wereld te verhuizen, maar de lange, donkere winter geeft haar veel rust en stilte om te werken.
En ze heeft het nodig. Ze is ook geïnteresseerd in kleine, gen-regulerende RNA-moleculen en, werken met onderzoekers in Berlijn, ze heeft de kleine RNA's in S. pyogenes in kaart gebracht. De resultaten hebben haar veel aan het denken gezet, omdat een van de kleine RNA-moleculen die in grote hoeveelheden in deze bacterie voorkomt een nog onbekende variant is, en de genetische code voor dit RNA ligt heel dicht bij de eigenaardige CRISPR-sequentie in het genoom van de bacterie.
De overeenkomsten tussen de twee doen Charpentier vermoeden dat ze met elkaar verbonden zijn. Zorgvuldige analyse van hun genetische codes onthult ook dat een deel van het kleine en onbekende RNA-molecuul overeenkomt met het deel van CRISPR dat wordt herhaald. Het is alsof je twee puzzelstukjes vindt die perfect in elkaar passen.
Charpentier had nog nooit met CRISPR gewerkt, maar haar onderzoeksgroep start een grondig microbiologisch speurwerk om het CRISPR-systeem in S. pyogenes in kaart te brengen. Dit systeem, die tot klasse 2 behoort, waarvan al bekend was dat het slechts één Cas-eiwit nodig had, Cas9, virus-DNA te splitsen. Charpentier laat zien dat het onbekende RNA-molecuul, dat trans-activerend crispr-RNA (tracrRNA) wordt genoemd, heeft ook een beslissende functie; het is nodig dat het lange RNA dat uit de CRISPR-sequentie in het genoom wordt gemaakt, uitgroeit tot zijn actieve vorm.
Na intensief en gericht experimenteren, Emmanuelle Charpentier publiceert de ontdekking van tracrRNA in maart 2011. Ze weet dat ze op de hielen zit met iets heel spannends. Ze heeft jarenlange ervaring in de microbiologie en wil bij haar voortdurende onderzoek naar het CRISPR-Cas9-systeem samenwerken met een biochemicus. Jennifer Doudna is de natuurlijke keuze. Dus dat voorjaar wanneer Charpentier wordt uitgenodigd voor een conferentie in Puerto Rico om over haar bevindingen te praten, haar doel is om deze bekwame Berkeley-onderzoeker te ontmoeten.
Een levensveranderende ontmoeting in een Puerto Ricaans café
Per toeval, ze ontmoeten elkaar in een café op de tweede dag van de conferentie. Een collega van Doudna stelt ze aan elkaar voor en, de volgende dag, Charpentier stelt voor dat ze samen de oude delen van de hoofdstad gaan verkennen. Terwijl ze door de geplaveide straten slenteren, ze beginnen te praten over hun onderzoek. Charpentier vraagt zich af of Doudna geïnteresseerd is in een samenwerking - zou ze willen deelnemen aan het bestuderen van de functie van Cas9 in het eenvoudige klasse 2-systeem van S. pyogenes?
Jennifer Doudna is geïntrigeerd, en zij en hun collega's maken plannen voor het project via digitale bijeenkomsten. Hun vermoeden is dat CRISPR-RNA nodig is om het DNA van een virus te identificeren, en dat Cas9 de schaar is die het DNA-molecuul afsnijdt. Echter, er gebeurt niets als ze dit in vitro testen. Het DNA-molecuul blijft intact. Waarom? Is er iets mis met de experimentele omstandigheden? Of heeft Cas9 een heel andere functie?
Na veel brainstormen en talloze mislukte experimenten, de onderzoekers voegen uiteindelijk tracrRNA toe aan hun tests. Eerder, ze geloofden dat tracrRNA alleen nodig was als CRISPR-RNA in zijn actieve vorm werd gesplitst, maar toen Cas9 eenmaal toegang had tot tracrRNA, gebeurde waar iedereen op zat te wachten:het DNA-molecuul werd in twee delen gesplitst.
Evolutionaire oplossingen hebben onderzoekers vaak verrast, maar dit was iets buitengewoons. Het wapen dat streptokokken hebben ontwikkeld als bescherming tegen virussen is eenvoudig en effectief, zelfs briljant. De geschiedenis van genetische scharen had hier kunnen stoppen; Charpentier en Doudna hadden in een bacterie een fundamenteel mechanisme ontdekt dat de mensheid veel leed veroorzaakt. Die ontdekking was op zich al verbazingwekkend, maar het toeval begunstigt voorbereide geesten.
Een baanbrekend experiment
De onderzoekers besluiten de genetische schaar te vereenvoudigen. Met behulp van hun nieuwe kennis over tracr-RNA en CRISPR-RNA, ze ontdekten hoe ze de twee konden samensmelten tot een enkel molecuul, die ze gids-RNA noemden. Met deze vereenvoudigde variant van de genetische schaar, vervolgens ondernemen ze een baanbrekend experiment:ze onderzoeken of ze dit genetische hulpmiddel kunnen besturen zodat het het DNA knipt op een door de onderzoekers bepaalde locatie.
Tegen deze tijd, de onderzoekers weten dat ze dicht bij een grote doorbraak staan. Ze nemen een gen dat al in een vriezer ligt in Doudna's laboratorium en selecteren vijf verschillende plekken waar het gen moet worden gesplitst. Vervolgens veranderen ze het CRISPR-gedeelte van de schaar, zodat de code overeenkomt met de code waar de sneden moeten worden gemaakt. Het resultaat was overweldigend. De DNA-moleculen werden op precies de juiste plaatsen gekliefd.
Genetische scharen veranderen de levenswetenschappen
Kort nadat Emmanuelle Charpentier en Jennifer Doudna in 2012 hun ontdekking van de genetische schaar CRISPR/Cas9 publiceerden verschillende onderzoeksgroepen tonen aan dat deze tool kan worden gebruikt om het genoom in cellen van zowel muizen als mensen te wijzigen, leidt tot explosieve ontwikkeling. Eerder, het veranderen van de genen in een cel, plant of organisme was tijdrovend en soms onmogelijk. Met behulp van de genetische schaar, onderzoekers kunnen – in principe – knippen in welk genoom ze maar willen. Na dit, het is gemakkelijk om de natuurlijke systemen van de cel te gebruiken voor DNA-reparatie, zodat ze de code van het leven herschrijven.
Omdat deze gentool zo gemakkelijk te gebruiken is, het is nu wijdverbreid in fundamenteel onderzoek. Het wordt gebruikt om het DNA van cellen en proefdieren te veranderen om te begrijpen hoe verschillende genen functioneren en op elkaar inwerken, zoals tijdens het verloop van een ziekte.
Genetische scharen zijn ook een standaardgereedschap geworden in de plantenveredeling. De methoden die onderzoekers eerder gebruikten om het genoom van planten te modificeren, vereisten vaak de toevoeging van genen voor antibioticaresistentie. Toen de gewassen werden geplant, het risico bestond dat deze antibioticaresistentie zich zou verspreiden naar de omringende micro-organismen. Dankzij de genetische schaar, onderzoekers hoeven deze oudere methoden niet meer te gebruiken, omdat ze nu zeer precieze veranderingen in het genoom kunnen aanbrengen. Onder andere, ze hebben de genen bewerkt die ervoor zorgen dat rijst zware metalen uit de grond opneemt, wat leidt tot verbeterde rijstvariëteiten met een lager gehalte aan cadmium en arseen. Onderzoekers hebben ook gewassen ontwikkeld die beter bestand zijn tegen droogte in een warmer klimaat, en die bestand zijn tegen insecten en ongedierte die anders met pesticiden zouden moeten worden bestreden.
Hoop op genezing van erfelijke ziekten
in de geneeskunde, de genetische schaar draagt bij aan nieuwe immuuntherapieën voor kanker en er zijn proeven gaande om een droom waar te maken:het genezen van erfelijke ziekten. Onderzoekers voeren al klinische proeven uit om te onderzoeken of ze CRISPR/Cas9 kunnen gebruiken voor de behandeling van bloedziekten zoals sikkelcelanemie en bèta-thalassemie, evenals erfelijke oogziekten.
Ze ontwikkelen ook methoden om genen in grote organen te herstellen, zoals de hersenen en spieren. Dierproeven hebben aangetoond dat speciaal ontworpen virussen de genetische schaar kunnen afleveren bij de gewenste cellen, het behandelen van modellen van verwoestende erfelijke ziekten zoals spierdystrofie, spinale musculaire atrofie en de ziekte van Huntington. Echter, de technologie moet nog verder worden verfijnd voordat ze op mensen kan worden getest.
De kracht van genetische schaar vereist regulering
Naast al hun voordelen, genetische schaar kan ook worden misbruikt. Bijvoorbeeld, met deze tool kunnen genetisch gemodificeerde embryo's worden gemaakt. Echter, er zijn al jaren wetten en regels die de toepassing van genetische manipulatie regelen, die een verbod inhouden om het menselijk genoom zodanig te wijzigen dat de veranderingen kunnen worden geërfd. Ook, experimenten waarbij mens en dier betrokken zijn, moeten altijd worden beoordeeld en goedgekeurd door ethische commissies voordat ze worden uitgevoerd.
Eén ding is zeker:deze genetische scharen raken ons allemaal. We zullen te maken krijgen met nieuwe ethische kwesties, maar dit nieuwe instrument kan heel goed bijdragen aan het oplossen van veel van de uitdagingen waarmee de mensheid nu wordt geconfronteerd. Door hun ontdekking, Emmanuelle Charpentier en Jennifer Doudna ontwikkelden een chemisch hulpmiddel dat de biowetenschappen naar een nieuw tijdperk heeft gebracht. Ze hebben ons doen staren naar een uitgestrekte horizon van onvoorstelbaar potentieel en, onderweg - terwijl we dit nieuwe land verkennen - zullen we gegarandeerd nieuwe en onverwachte ontdekkingen doen.
© 2020 The Associated Press. Alle rechten voorbehouden. Dit materiaal mag niet worden gepubliceerd, uitzending, herschreven of gedistribueerd zonder toestemming.
 Nieuwe methode voor het labelen van DNA-basen voor sequencing
Nieuwe methode voor het labelen van DNA-basen voor sequencing Nieuwe techniek verhoogt 3D-printsnelheid met 1, 000 tot 10, 000 keer
Nieuwe techniek verhoogt 3D-printsnelheid met 1, 000 tot 10, 000 keer Science Project: The Evaporation of Fresh Water Vs. Zout Water
Science Project: The Evaporation of Fresh Water Vs. Zout Water Onderzoek toont aan dat druk ongewoon hoge elektrische geleidbaarheid induceert in polyjodide
Onderzoek toont aan dat druk ongewoon hoge elektrische geleidbaarheid induceert in polyjodide Welk soort warmteoverdracht doet zich voor in vloeistoffen & gassen?
Welk soort warmteoverdracht doet zich voor in vloeistoffen & gassen?
 Waarom wereldwijde milieuactivisten zwijgen over de mijnbouwcrisis in Venezuela
Waarom wereldwijde milieuactivisten zwijgen over de mijnbouwcrisis in Venezuela Nieuwe satellietkaart toont grondvervorming na Indonesische aardbeving
Nieuwe satellietkaart toont grondvervorming na Indonesische aardbeving Vulkaan Bali stoot piekerige stoompluim uit, vluchten hervatten
Vulkaan Bali stoot piekerige stoompluim uit, vluchten hervatten Geluidsoverlast het hardst in zwarte wijken, gescheiden steden
Geluidsoverlast het hardst in zwarte wijken, gescheiden steden Wolkencamera Gemini Observatory legt dramatische gloed van vulkanen vast
Wolkencamera Gemini Observatory legt dramatische gloed van vulkanen vast
Hoofdlijnen
- Relatie tussen DNA-basen Genen, eiwitten en eigenschappen
- Onderzoeker ontdekt dat wanneer sperma concurreert, eieren hebben een keuze
- Hoe wordt water gevormd tijdens cellulaire ademhaling?
- De handel in neushoornhoorn legaliseren - reken niet blindelings aan
- Wat is het doel van de promotor en terminatorregio van de DNA-molecule?
- Moeite met onthouden? Vertel je vrienden om een wandeling te maken
- Een buitengewoon grotdier gevonden in Oost-Turkmenistan
- Welke effecten kunnen glycolyse remmen?
- Hoe groeit schimmel op brood?
- Etherische oliën herstellen de effectiviteit van insecticiden tegen bedwantsen

- Kan ik die chemicaliën mengen? Daar is een app voor!

- Inzicht in de gasstroom voor verbeterde toepassingen voor schone energie

- Glashelder maken:kristalliniteit vermindert de weerstand in volledig solid-state batterijen
- Complex levend weefsel bioprinten in slechts enkele seconden

 Wetenschappers pionieren met nieuw chemisch conversieproces bij lage temperatuur
Wetenschappers pionieren met nieuw chemisch conversieproces bij lage temperatuur Hoe Epicenter berekenen
Hoe Epicenter berekenen  Ervaring in Georgia County toont gevaren van ransomware aan
Ervaring in Georgia County toont gevaren van ransomware aan Hoe Delta tussen twee getallen te berekenen
Hoe Delta tussen twee getallen te berekenen Meterblokgeleider ondersteunt dimensionale metingen in de industrie
Meterblokgeleider ondersteunt dimensionale metingen in de industrie Waarom slagen we er nog steeds niet in om de ontbossing te stoppen?
Waarom slagen we er nog steeds niet in om de ontbossing te stoppen? Hoe dichtheid te converteren naar een specifieke zwaartekracht
Hoe dichtheid te converteren naar een specifieke zwaartekracht  Egypte onthult 59 oude doodskisten gevonden in de buurt van Saqqara-piramides
Egypte onthult 59 oude doodskisten gevonden in de buurt van Saqqara-piramides
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com

