Wetenschap
S100A9-amyloïden op Aβ-fibrillaire oppervlakken onthuld
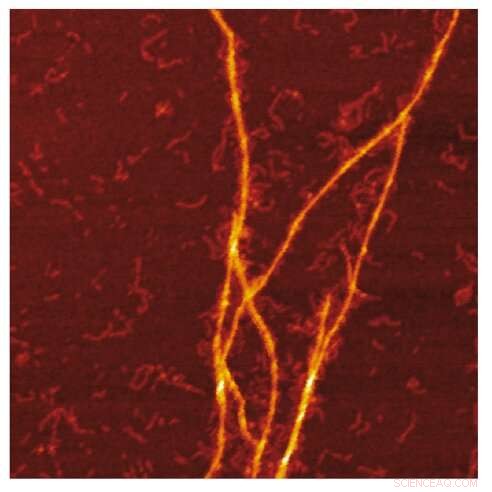
AFM-beeld van de amyloïde-templating van S100A9-fibrillen op het oppervlak van Aβ-fibrillen. Krediet:Jonathan Pansieri
Een onderzoeksteam onder leiding van Ludmilla Morozova Roche aan de Universiteit van Umeå, Zweden, heeft het mechanistische inzicht verschaft in eiwitco-aggregatie bij de ziekte van Alzheimer. Het sjabloonmechanisme van S100A9-amyloïden op Aβ-fibrillaire oppervlakken tijdens het co-aggregatieproces werd onthuld door synergie van biofysische methoden, waaronder massaspectrometrie voor ladingsdetectie, microscopie, kinetische en microfluïdische analyses.
Amyloïdevorming is van de belangrijkste klinische betekenis, aangezien dit proces betrokken is bij tal van neurodegeneratieve ziekten zoals de ziekte van Alzheimer, Parkinson en anderen. Deze ziekten treffen miljoenen van de vergrijzende bevolking wereldwijd. Vaak is het moeilijk om de grens tussen deze ziekten te trekken of kunnen ze gelijktijdig voorkomen, wat bekend staat als ziekte comorbiditeit.
Hoewel het proces van amyloïdvorming uitgebreid werd bestudeerd, er is weinig bekend over de specifieke mechanismen van co-aggregatie van verschillende amyloïde soorten samen, die ten grondslag liggen aan de comorbiditeit van de ziekten. Bij de ziekte van Alzheimer, de amyloïde-neuro-inflammatoire cascade komt tot uiting in co-aggregatie van Aβ met pro-inflammatoir S100A9-eiwit, wat leidt tot intracellulaire en extracellulaire amyloïde assemblage, amyloïde plaque-afzettingen en cellulaire toxiciteit.
Het ontcijferen van de interacties tussen pro-inflammatoir S100A9-eiwit en Aβ42-peptide bij de ziekte van Alzheimer is van fundamenteel belang, aangezien ontsteking een centrale rol speelt bij het ontstaan van de ziekte. Hier gebruiken de onderzoekers innovatieve massaspectrometrie voor ladingsdetectie (CDMS) samen met biofysische technieken om mechanistisch inzicht te geven in het co-aggregatieproces en om amyloïdecomplexen op een enkel deeltjesniveau te differentiëren.
Combinatie van massa- en ladingsverdelingen van amyloïden samen met reconstructie van de verschillen daartussen en gedetailleerde microscopie onthult dat co-aggregatie het modelleren van S100A9-fibrillen op het oppervlak van Aβ42-amyloïden omvat. Kinetische analyse bevestigt verder dat de oppervlakken die beschikbaar zijn voor de secundaire nucleatie van Aβ42 worden verminderd als gevolg van coating door S100A9-amyloïden, terwijl de binding van S100A9 aan Aβ42-fibrillen wordt gevalideerd door een microfuïdische test.
De onderzoekers tonen aan dat synergie tussen CDMS, microscopie, kinetische en microfuïdische analyses openen nieuwe richtingen in interdisciplinair onderzoek.
 Internationaal team van wetenschappers voltooit de grootste wereldwijde beoordeling van de gevolgen van de opwarming van de oceaan
Internationaal team van wetenschappers voltooit de grootste wereldwijde beoordeling van de gevolgen van de opwarming van de oceaan Vervuild water maakt bijna 500 ziek in China
Vervuild water maakt bijna 500 ziek in China Defecte opslagtanks vormen atmosferische risico's tijdens rampen
Defecte opslagtanks vormen atmosferische risico's tijdens rampen Ontbossing verduistert de zeeën boven het op een na grootste rif ter wereld
Ontbossing verduistert de zeeën boven het op een na grootste rif ter wereld Nieuw onderzoek toont aan dat bosbeheer in de gemeenschap zowel ontbossing als armoede vermindert
Nieuw onderzoek toont aan dat bosbeheer in de gemeenschap zowel ontbossing als armoede vermindert
Hoofdlijnen
- Biologen ontdekken tastzin van bacteriën
- Nieuwe studie wijst op onverwachte voordelen van rabiësvaccinatie bij honden
- Supercoiling duwt moleculaire handboeien langs chromatinevezels
- Projectideeën om het menselijke spijsverteringsstelsel te laten zien op de middelbare school voor studenten
- Inzicht in onze levensduur van meer dan 50 jaar die nog steeds in ontwikkeling is, genetische studie toont aan
- Onderzoek toont verschillen in energieverteerbaarheid tussen zeugen en gelten
- Gewone schimmel helpt het knokkelkoortsvirus te gedijen bij muggen
- Video van vier bobcats in een buitenwijk toont gezonde populatie
- Wat is de structurele classificatie van het zenuwstelsel?
 VAE kent grote raffinagecontracten toe aan Korea's Samsung
VAE kent grote raffinagecontracten toe aan Korea's Samsung Team gebruikt eiwitten op zonne-energie om schadelijke antibiotica uit water te filteren
Team gebruikt eiwitten op zonne-energie om schadelijke antibiotica uit water te filteren Hoe de slogan 'Ik keur het goed' nare politieke advertenties stimuleert
Hoe de slogan 'Ik keur het goed' nare politieke advertenties stimuleert Voorspelling van wateropslag na 2-5 jaar in wereldwijde semi-aride regio's
Voorspelling van wateropslag na 2-5 jaar in wereldwijde semi-aride regio's Onderzoekers dateren de ouderdom van het oudst bekende bos in de regio West Junggar, China
Onderzoekers dateren de ouderdom van het oudst bekende bos in de regio West Junggar, China Eerste directe datering van Homo antecessor
Eerste directe datering van Homo antecessor Nabootsen hoe water en wind complexe vormen in de natuur creëren
Nabootsen hoe water en wind complexe vormen in de natuur creëren Snelheidsafhankelijke aantrekkingskracht bepaalt wat er in het hart van muggenzwermen gebeurt
Snelheidsafhankelijke aantrekkingskracht bepaalt wat er in het hart van muggenzwermen gebeurt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | French |

-
Wetenschap © https://nl.scienceaq.com