Wetenschap
Hoe worden eiwitklitten zo lang bij Alzheimer?
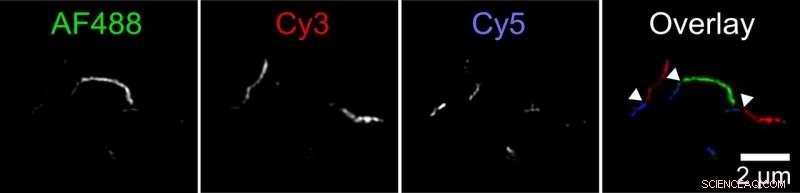
Biofysici hebben een nieuw mechanisme ontdekt waarmee aggregaten van tau-eiwit, genaamd fibrillen, kan groeien. Twee fibrillen kunnen end-to-end worden bevestigd. Deze afbeelding toont een fibril die is samengesteld uit kleinere fibrillen die in drie kleuren zijn gelabeld. De onderzoeker labelde tau-eiwitten met drie verschillende fluorescerende kleurstoffen en liet ze aggregeren in afzonderlijke reageerbuizen. Vervolgens mengde ze deze verschillend gekleurde fibrillen in een vierde reageerbuis. Beelden gemaakt met een superresolutie fluorescentiemicroscoop toonden lange fibrillen met korte secties van elke kleur, wat aangeeft dat fibrillen van originele reageerbuizen verbonden uiteinden moeten hebben om langere fibrillen te vormen. Krediet:Carol Huseby/Ohio State University
Vroeg in de loop van de ziekte van Alzheimer - lang voordat toekomstige patiënten symptomen beginnen op te merken - beginnen zich neurofibrillaire kluwens te vormen die zijn samengesteld uit tau-eiwitaggregaten in hun hersencellen. Hoe giftig deze aggregaten zijn en hoe goed ze zich verspreiden, hangt af van hun grootte. Echter, wetenschappers die kluwenvorming bestuderen, hebben niet kunnen verklaren waarom kabelachtige tau-aggregaten van verschillende groottes bij ziekten voorkomen.
Maar nu, onderzoekers van de Ohio State University hebben ontdekt dat in plaats van slechts één eiwit per keer toe te voegen, fibrillen van verschillende lengtes kunnen end-to-end worden samengevoegd om één langer filament te creëren. de bevinding, die zal verschijnen in de Tijdschrift voor biologische chemie op maandag, helpt verklaren hoe fibrillen kunnen groeien tot honderden nanometers en kan onderzoekers ook helpen mechanismen te begrijpen van een opkomende groep kandidaat-geneesmiddelen die zijn ontworpen om tau-aggregatie te remmen.
Wetenschappers kunnen wiskundige modellen gebruiken om biologische processen zoals fibrilvorming te beschrijven. Een algemeen eenvoudig model van tau-aggregatie omvat twee stappen. In de eerste stap, twee tau-eiwitten binden langzaam, en, in de tweede stap, extra tau-moleculen klikken snel vast.
Eerste auteur Carol Huseby, een afgestudeerde student in het lab van Jeff Kuret, in samenwerking met Ralf Bundschuh, uiteengezet om dit wiskundige model uit te breiden met andere bekende manieren waarop tau-fibrillen zich gedragen. Wetenschappers hebben waargenomen, bijvoorbeeld, dat soms een fibril in twee fragmenteert. Andere tijden, een nieuwe fibril kan nucleëren in het midden van een bestaande fibril.
Het eenvoudige tweestapsmodel voorspelde dat een reageerbuis gevuld met gezuiverd tau-eiwit zou resulteren in een groot aantal korte fibrillen. Maar Huseby wist dat wanneer onderzoekers geaggregeerd tau-eiwit onder een microscoop bekijken, ze zien een kleiner aantal lange fibrillen. Die discrepantie suggereerde dat er in de echte wereld iets gebeurde waar in het model geen rekening mee was gehouden. Ze veronderstelden dat korte fibrillen misschien van begin tot eind zouden kunnen hechten om langer te worden.
Huseby voerde een reeks experimenten uit om de hypothese te testen. In een, eerst labelde ze tau-eiwitten met drie verschillende fluorescerende kleuren en liet ze aggregeren in afzonderlijke reageerbuizen. Vervolgens mengde ze deze verschillend gekleurde fibrillen in een vierde reageerbuis.
Beelden gemaakt met een superresolutie fluorescentiemicroscoop toonden lange fibrillen met korte secties van elke kleur, wat aangeeft dat fibrillen van originele reageerbuizen verbonden uiteinden moeten hebben om langere fibrillen te vormen. Controle-experimenten hebben vastgesteld dat dit niet kan worden verklaard door de voorkeur van gelabelde moleculen voor soortgelijke labels.
Nadat Huseby dit nieuwe mechanisme in het model had verwerkt, het gaf een veel betere beschrijving van wat gezuiverde tau-eiwitten werkelijk aan het doen waren toen ze aggregaten vormden. Deze studie is de eerste die aantoont dat de fibrillen met meer dan een enkel tau-eiwit tegelijk kunnen verlengen.
Alzheimer-onderzoekers proberen nog steeds te onderscheiden of tau-fibrillen een oorzaak of gewoon een gevolg van de ziekte zijn. Een mogelijkheid is dat overdracht van fibrillen van de ene cel naar de andere kan bijdragen aan de verspreiding van ziekten in de hersenen. Een zeer lange vezel, volgens Kuret, het is onwaarschijnlijk dat het zich op deze manier zal verspreiden. "Maar als het eenmaal in kleine stukjes is gebroken, die kunnen diffunderen, het vergemakkelijken van hun verplaatsing van cel naar cel."
Deze studie gebruikte slechts één type tau. Er zijn zes isovormen van verschillende lengte bekend, en fosforylering en andere veranderingen verhogen de complexiteit van het eiwit. De onderzoekers zijn van plan om deze variabelen in toekomstig werk op te nemen, en om het model te gaan gebruiken om te begrijpen hoe tau-remmers het gedrag van de eiwitaggregaten veranderen.
Hoofdlijnen
- Studie werpt nieuw licht op de overleving van krilllarven
- Hoe bouw je een DNA-model uit tandenstokers
- Keizerspinguïns kunnen record snel inkorten door te snacken
- 10 planten verloren in de geschiedenis
- Hoe succesvol te zijn in Microbiology
- Stadia van een typische celcyclus
- Wat zijn de vijf onderverdelingen van koninkrijken?
- Is de Krebs-cyclus aëroob of anaëroob?
- Noord-Amerikaanse primeur:onderzoekers publiceren wetenschappelijke studie over cannabisproductie
 Canadese toendra vroeger bedekt met rijk bos, oude fossielen van planten laten zien
Canadese toendra vroeger bedekt met rijk bos, oude fossielen van planten laten zien Video:Wat zijn forever chemicaliën, en gaan ze voor altijd mee?
Video:Wat zijn forever chemicaliën, en gaan ze voor altijd mee? Maatschappelijke kosten van koolstof:wat is het, en waarom moeten we het berekenen?
Maatschappelijke kosten van koolstof:wat is het, en waarom moeten we het berekenen? De originele prijs vinden
De originele prijs vinden Kwantumchemici toveren recept om goud te veranderen, zilver en koper in vaten van groene energie
Kwantumchemici toveren recept om goud te veranderen, zilver en koper in vaten van groene energie Landing op de oorsprong van het leven
Landing op de oorsprong van het leven Nieuw materiaal maakt de weg vrij voor informatietechnologie van de volgende generatie
Nieuw materiaal maakt de weg vrij voor informatietechnologie van de volgende generatie Eetbare wilde paddestoelen in Illinois
Eetbare wilde paddestoelen in Illinois
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com