
Wetenschap
De wereld duurzaam van brandstof voorzien:ammoniak synthetiseren met minder energie
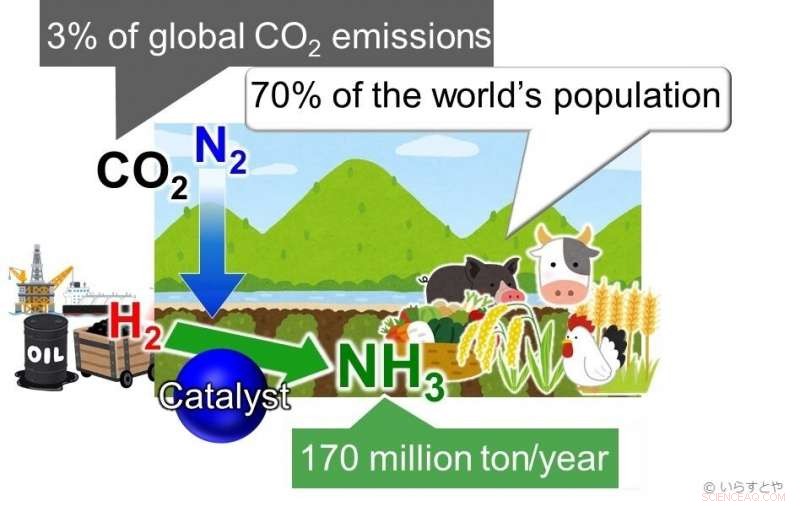
Ammoniak (NH3) is tegenwoordig een van de belangrijkste industriële chemicaliën, wereldwijd gesynthetiseerd voor gebruik in meststoffen die vervolgens voedselproductie mogelijk maken voor ongeveer 70% van de wereldbevolking. Ammoniak wordt momenteel gewonnen door stikstof (N2) uit lucht te laten reageren met waterstof (H2). Deze reactie vereist hoge energie en is, daarom, aangedreven door fossiele brandstoffen, bijdragen aan meer dan 3% van de wereldwijde CO2-uitstoot. Krediet:Irasutoya, Michikazu Hara
Wetenschappers van het Tokyo Institute of Technology (Tokyo Tech) hebben een verbeterde katalysator ontwikkeld door het gebruikelijke dehydratatiemiddel calciumhydride te nemen en er fluoride aan toe te voegen. De katalysator vergemakkelijkt de synthese van ammoniak bij slechts 50 °C, door slechts de helft van de energie te gebruiken die bestaande technieken nodig hebben. Dit opent deuren naar ammoniakproductie met een laag energieverbruik en verminderde uitstoot van broeikasgassen.
Ammoniak is essentieel voor het maken van plantenmest, die op zijn beurt ongeveer 70% van de wereldbevolking voedt. In industrie, ammoniak wordt geproduceerd via het Haber-Bosch-proces, waar methaan eerst wordt omgezet met stoom om waterstof te produceren, en waterstof wordt vervolgens omgezet met stikstof om ammoniak te geven. Het probleem met dit proces is dat naarmate de temperatuur stijgt, het rendement daalt. Om een goed rendement te blijven behalen, de in de reactiekamer toegepaste druk moet worden verhoogd. Dit vraagt veel energie. Verder, de op ijzer gebaseerde katalysatoren die voor de reactie worden gebruikt, zijn alleen effectief boven 350 ° C. Het handhaven van dergelijke hoge temperaturen vereist ook een aanzienlijke hoeveelheid energie. Als klap op de vuurpijl de opbrengst is slechts 30-40%.
Fossiele brandstoffen worden momenteel gebruikt om het proces aan te drijven, grote hoeveelheden koolstofdioxide aan de atmosfeer bijdragen. Alternatieven voor hernieuwbare bronnen, zoals windenergie, Zijn toegepast, maar die zijn niet duurzaam gebleken. Om de opbrengst te verhogen en tegelijkertijd de schade aan het milieu te verminderen, daarom, de reactie moet bij lage temperaturen plaatsvinden. Om dit te laten gebeuren, katalysatoren die de reactie bij lage temperaturen mogelijk maken, zijn vereist.
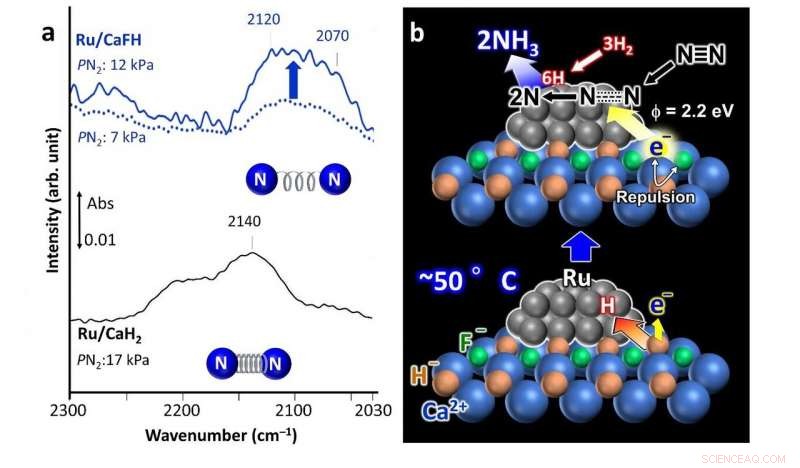
a) Fourier Transform Infrarood (FT-IR) spectra voor stikstofadsorptie op de ontwikkelde fluoride-bevattende Ru/CaFH-katalysator (boven) die een verzwakte binding tussen stikstofatomen vertoont in vergelijking met een niet-gemodificeerde Ru/CaH2-katalysator (onderste spectrum). b) Voorgesteld reactiemechanisme met gebruikmaking van de Ru/CaFH-katalysator. Credit: Natuurcommunicatie
Tot dusver, dergelijke katalysatoren zijn ongrijpbaar geweest voor wetenschappers. "Conventionele katalysatoren verliezen de katalytische activiteit voor ammoniakvorming uit N 2 en H 2 gassen bij 100-200 °C, zelfs als ze hoge katalytische prestaties vertonen bij hoge temperaturen, " merkt een groep wetenschappers van Tokyo Tech op, Japan, die het katalysatorprobleem eindelijk lijken te hebben opgelost. De wetenschappers, geleid door Dr. Michikazu Hara, een katalysator ontwikkeld die zelfs bij 50 °C effectief is. "Onze katalysator produceert ammoniak uit N 2 en H 2 gassen bij 50 °C met een extreem kleine activeringsenergie van 20 kJmol -1 , wat minder is dan de helft van wat is gerapporteerd voor conventionele katalysatoren, " Dr. Hara en collega's rapporteren in hun paper gepubliceerd in Natuurcommunicatie .
Hun katalysator bestaat uit een vaste oplossing van CaFH, met ruthenium (Ru) nanodeeltjes afgezet op het oppervlak. De toevoeging van fluoride (F - ) tot calciumhydride (CaH 2 ), een veelgebruikt dehydratatiemiddel, is wat de katalysator effectief maakt bij lagere temperaturen en drukken. Na het uitvoeren van spectroscopische en computationele analyses, de wetenschappers stellen een mogelijk mechanisme voor waarmee de katalysator de ammoniakproductie vergemakkelijkt.
De calcium-fluoride (Ca-F) binding is sterker dan de calcium-waterstof (Ca-H) binding. Dus, de aanwezigheid van de Ca-F-binding verzwakt de Ca-H-binding en de Ru kan H-atomen uit het katalysatorkristal halen, elektronen op hun plaats laten. De H-atomen desorberen vervolgens van de Ru-nanodeeltjes als H 2 gas. Dit gebeurt zelfs bij 50°C. De resulterende ladingsafstoting tussen de gevangen elektronen en F - ionen in het kristal verlagen de energiebarrières voor deze elektronen om vrij te geven, waardoor het materiaal een hoog elektronendonerend vermogen krijgt. Deze vrijgekomen elektronen vallen de bindingen tussen de stikstofatomen in de N . aan 2 gas, het vergemakkelijken van de productie van ammoniak.
Deze nieuwe methode van ammoniakproductie vermindert de energiebehoefte, waardoor de uitstoot van kooldioxide door het gebruik van grote hoeveelheden fossiele brandstoffen wordt verminderd. De bevindingen van deze studie belichten de mogelijkheid van een ecologisch duurzaam Haber-Bosch-proces, de deur openen naar de volgende revolutie in de voedselproductie in de landbouw.
 VN-chef ziet steden, bedrijven vullen Amerikaanse leegte op klimaat
VN-chef ziet steden, bedrijven vullen Amerikaanse leegte op klimaat Nieuw door zonne-energie geïnduceerd chlorofylfluorescentieproduct heeft tot doel het onderzoek naar koolstofneutraliteit te verbeteren
Nieuw door zonne-energie geïnduceerd chlorofylfluorescentieproduct heeft tot doel het onderzoek naar koolstofneutraliteit te verbeteren Terra Satellite vindt Shanshans kracht ondermijnd
Terra Satellite vindt Shanshans kracht ondermijnd UTSA maakt webgebaseerd open source-dashboard van North Pole
UTSA maakt webgebaseerd open source-dashboard van North Pole De bijdrage van de luchtvaart aan het terugdringen van de klimaatverandering zal waarschijnlijk klein zijn
De bijdrage van de luchtvaart aan het terugdringen van de klimaatverandering zal waarschijnlijk klein zijn
Hoofdlijnen
- RNA-ontdekking kan de plantwarmte helpen verhogen, droogtetolerantie
- Wat is het voordeel van het gebruik van vlekken om naar cellen te kijken?
- Nucleic Acid Facts
- Seizoensgebonden afbeeldingen onthullen de wetenschap achter stamcellen
- Wat zijn twee manieren waarop Enzymen minder effectief worden?
- Cellulaire ademhaling: definitie, vergelijking en stappen
- Wetenschappers vinden bewijs van onze beste vrienden, honden, op dezelfde manier aangepast aan malaria in Afrika
- Biomassa versus energiepiramides
- Nieuwe inzichten in de belangrijkste oorzaak van een miskraam, geboorteafwijkingen ontdekt
- Fijne structuur onthuld van potentieel alternatief voor loodverbinding gebruikt in sensoren
- Zachte dubbele gyroids zijn uniek, maar onvolmaakt, Kristallen

- Nanostructuren van elektrokatalysatoren sleutel tot verbeterde brandstofcellen, elektrolyzers
- Het verlichten van kleine eiwitten in levende cellen met behulp van labelling-tags met één residu
- Ontwikkeling van betere fabricagetechnieken voor pH-responsieve microcapsules

 Ecologisch functioneren van stedelijke vaarwegen
Ecologisch functioneren van stedelijke vaarwegen Bezoekerspatronen en opkomende activiteiten in nationale parken onthuld door posts op sociale media
Bezoekerspatronen en opkomende activiteiten in nationale parken onthuld door posts op sociale media INLs TREAT-reactor voltooit met succes het eerste van brandstof voorziene experiment
INLs TREAT-reactor voltooit met succes het eerste van brandstof voorziene experiment De Taj Mahal is aan het wegkwijnen, en het kan binnenkort het point of no return bereiken
De Taj Mahal is aan het wegkwijnen, en het kan binnenkort het point of no return bereiken Experimenten over het reinigen van Pennies
Experimenten over het reinigen van Pennies Vissers willen graag helpen het probleem van zwerfvuil op zee aan te pakken
Vissers willen graag helpen het probleem van zwerfvuil op zee aan te pakken De effecten van waterverontreiniging op de groei van planten
De effecten van waterverontreiniging op de groei van planten Gebruik van sociale media in China, VS kunnen de strategie van sportorganisaties informeren
Gebruik van sociale media in China, VS kunnen de strategie van sportorganisaties informeren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

