
Wetenschap
Koperionen kunnen een sleutelrol spelen wanneer het vouwen van peptiden fout gaat
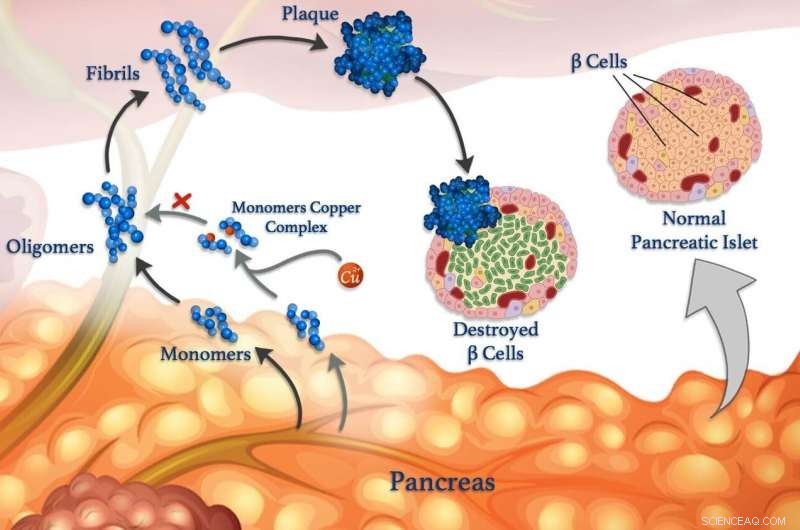
Koperionen (rode bolletjes) kunnen zich hechten aan peptidemonomeren (blauw) en voorkomen dat ze samenklonteren om oligomeren te vormen, fibrillen en schadelijke plaques. © 2020 Mawadda Alghrably
Het ontrafelen van interacties tussen metaalionen en peptiden in het lichaam kan uiteindelijk leiden tot betere behandelingen voor diabetes, Alzheimer en andere ziekten. Het begrijpen van deze interacties is de focus van onderzoek, mede geleid door KAUST, dat onthult hoe metalen, zoals koper, kan de vorming van schadelijke klonten van verkeerd gevouwen peptideclusters, fibrillen genaamd, beïnvloeden, die ten grondslag liggen aan veel ziekten.
Dwalende peptiden zijn gekoppeld aan neurologische aandoeningen zoals de ziekte van Alzheimer, evenals voor diabetes onder controle van de bloedsuikerspiegel. Bloedsuikerspiegels worden normaal gesproken gecontroleerd via peptidehormonen die worden afgegeven door gespecialiseerde cellen, -cellen genaamd. Evenals insuline, gezonde β-cellen geven ook amyline af, een peptidehormoon dat helpt om pieken in de bloedsuikerspiegel na het eten te verminderen door de maaglediging te vertragen. Maar amyline is vatbaar voor het vormen van verkeerd gevouwen klonten, vooral in aanwezigheid van koperionen, die -cellen beschadigen en bijdragen aan diabetes type II.
Echter, metaalionen kunnen in sommige omstandigheden ook de aggregatie van peptiden tegengaan, zegt KAUST-onderzoeker, Mariusz Jaremko, die het werk leidde in samenwerking met onderzoekers van de Universiteit van Wroclaw in Polen. Om het proces in meer detail te bestuderen, het team onderzoekt de interactie tussen koper(II)-ionen en amyline en zijn moleculaire analogen. "Zulke kennis zou ons inzicht geven in de moleculaire mechanismen van type II diabetes, waardoor we nieuwe strategieën en therapieën kunnen ontwikkelen tegen deze ziekte, ' zegt Jaremko.
In hun laatste werk, het team bestudeerde de invloed van koperionen op de aggregatie van twee analogen van menselijke amyline:een amyline-nabootsend medicijn genaamd pramlintide en amyline van ratten. "We ontdekten dat verschillen in de structuren van pramlintide en rattenamyline betekenen dat koperionen de aggregatie van pramlintide belemmeren, maar geen rattenamyline, " zegt Mawadda Alghrably, een doctoraat student in het team van Jaremko.
De onderzoekers onderzochten het proces met behulp van meerdere technieken, inclusief nucleaire magnetische resonantie (in samenwerking met Abdul-Hamid Emwas van KAUST CoreLabs), en een "thioflavine T" fluorescentietest van eiwitaggregatie. Ze ontdekten dat hoewel beide amyline-analogen koper binden, pramlintide kan het op twee verschillende manieren binden vanwege een extra koperbindend histidine-aminozuur dat aanwezig is in pramlintide maar niet in rattenamyline. Koper-ionbinding aan dit histidine verklaarde waarschijnlijk waarom koper de pramlintide-aggregatie verminderde, maar niet de amyline-aggregatie van ratten, concludeerden de onderzoekers.
Het team blijft de moleculaire basis van amyline-aggregatie ontcijferen, Zegt algbaar. "Begrijpen hoe deze moleculen zich gedragen, kan uiteindelijk helpen om het ontwerp van nieuwe efficiënte geneesmiddelen en therapieën voor diabetes type II te vergemakkelijken, " ze zegt.
 Hoe Mmol berekenen
Hoe Mmol berekenen  Onderzoekers identificeren de innerlijke werking van cellulaire calciumpompen
Onderzoekers identificeren de innerlijke werking van cellulaire calciumpompen Onderzoeksteam ontwikkelt goedkope, nauwkeurig COVID-19 antilichaamdetectieplatform
Onderzoeksteam ontwikkelt goedkope, nauwkeurig COVID-19 antilichaamdetectieplatform Nieuwe efficiënte katalysator voor belangrijke stap in kunstmatige fotosynthese
Nieuwe efficiënte katalysator voor belangrijke stap in kunstmatige fotosynthese Optische parameters ontrafelen:nieuwe methode om plasmon-versterkte spectroscopie te optimaliseren
Optische parameters ontrafelen:nieuwe methode om plasmon-versterkte spectroscopie te optimaliseren
 Hittegolven in de oceaan verwoesten dieren in het wild, erger om te komen
Hittegolven in de oceaan verwoesten dieren in het wild, erger om te komen Miljardair Bloomberg zegt $ 15 miljoen toe aan VN voor klimaatverandering
Miljardair Bloomberg zegt $ 15 miljoen toe aan VN voor klimaatverandering iSeeFlood-applicatie nu beschikbaar op iPhones
iSeeFlood-applicatie nu beschikbaar op iPhones Nieuwe Amerikaanse wet vereist onderzoek naar nucleaire stortplaats op de Marshalleilanden die wordt bedreigd door stijgende zeeën
Nieuwe Amerikaanse wet vereist onderzoek naar nucleaire stortplaats op de Marshalleilanden die wordt bedreigd door stijgende zeeën Wat zijn de functies van het graslandecosysteem?
Wat zijn de functies van het graslandecosysteem?
Hoofdlijnen
- Hoe planten hun zaden vormen
- Welk enzym is verantwoordelijk voor het verlengen van de RNA-keten?
- Voedingsvormen van bacteriën
- Interne krachten die celmigratie sturen, worden onthuld door microscopie met levende cellen
- Vergroening van citrusvruchten behandelen met koper:effecten op bomen, bodems
- Typen biologie-experimenten
- Chloroplast & Mitochondria: wat zijn de overeenkomsten en verschillen?
- El Nino in de Stille Oceaan heeft invloed op dolfijnen in West-Australië
- Techniek op de plaats delict die wordt gebruikt om schildpadden te volgen
- Biochemicus ontdekt veelbelovend enzym om kankercellen te bestrijden
- Wetenschappers identificeren moleculen die cellen hadden kunnen helpen om te overleven - en te gedijen - op de vroege aarde

- Van de weegschaal:Vispantser zowel sterk als flexibel

- Nanodiamanten als fotokatalysatoren

- Wetenschappers synthetiseren een nieuwe stof met antitumorale eigenschappen

 Hoe beschermen walvissen zichzelf?
Hoe beschermen walvissen zichzelf?  Eerste commerciële elektrische vliegtuig vliegt in Canada
Eerste commerciële elektrische vliegtuig vliegt in Canada Zijn onderdoorgangen veilig tijdens een tornado?
Zijn onderdoorgangen veilig tijdens een tornado?  Hoe lineaire dichtheid te berekenen
Hoe lineaire dichtheid te berekenen Rapport vindt verbeteringen in de algehele gezondheid van Chesapeake Bays
Rapport vindt verbeteringen in de algehele gezondheid van Chesapeake Bays Feiten over Colorado State voor Kids
Feiten over Colorado State voor Kids Het vermogen van bomen om koolstof op te slaan bij twijfel na baanbrekend Australisch onderzoek
Het vermogen van bomen om koolstof op te slaan bij twijfel na baanbrekend Australisch onderzoek Veranderen hoe we koraalverbleking voorspellen
Veranderen hoe we koraalverbleking voorspellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

