
Wetenschap
Kooldioxide verwijderen uit uitlaatgassen van elektriciteitscentrales

MIT-assistent-professor Betar Gallant (links) en afgestudeerde student Aliza Khurram ontwikkelen een nieuwe batterij die zowel koolstofdioxide in de uitlaat van energiecentrales kan opvangen als deze kan omzetten in een vaste stof die klaar is voor veilige verwijdering. Credit:Stuart Darsch
Vermindering van kooldioxide (CO 2 ) emissies van elektriciteitscentrales wordt algemeen beschouwd als een essentieel onderdeel van elk plan om klimaatverandering tegen te gaan. Veel onderzoeksinspanningen zijn gericht op het ontwikkelen en inzetten van systemen voor het opvangen en vastleggen van koolstof (CCS) om CO . te behouden 2 emissies van elektriciteitscentrales uit de atmosfeer. Maar het scheiden van de afgevangen CO 2 en door het weer om te zetten in een gas dat kan worden opgeslagen, kan tot 25 procent van de elektriciteitsopwekkingscapaciteit van een centrale worden verbruikt. In aanvulling, de CO 2 gas wordt over het algemeen geïnjecteerd in ondergrondse geologische formaties voor langdurige opslag - een verwijderingsmethode waarvan de veiligheid en betrouwbaarheid onbewezen blijven.
Een betere aanpak zou zijn om de afgevangen CO . om te zetten in 2 in nuttige producten zoals brandstoffen met toegevoegde waarde of chemicaliën. Daartoe, de aandacht is gericht op elektrochemische processen - in dit geval een proces waarbij bij chemische reacties elektrische energie vrijkomt, zoals bij het ontladen van een batterij. Het ideale medium om de elektrochemische omzetting van CO . uit te voeren 2 water zou blijken te zijn. Water kan de protonen (positief geladen deeltjes) leveren die nodig zijn om brandstoffen zoals methaan te maken. Maar het runnen van dergelijke "waterige" (op water gebaseerde) systemen vereist grote energie-inputs, en slechts een klein deel van de gevormde producten is typisch die van belang.
Betar Gallant, een assistent-professor werktuigbouwkunde, en haar groep aan het MIT hebben zich daarom gericht op niet-waterige (watervrije) elektrochemische reacties, in het bijzonder degenen die voorkomen in lithium-CO 2 batterijen.
Onderzoek naar lithium-CO 2 batterijen staat nog in de kinderschoenen, volgens Gallant, maar de belangstelling ervoor groeit omdat CO 2 wordt verbruikt in de chemische reacties die plaatsvinden op een van de elektroden terwijl de batterij wordt ontladen. Echter, CO 2 is niet erg reactief. Onderzoekers hebben geprobeerd de zaken te versnellen door verschillende elektrolyten en elektrodematerialen te gebruiken. Ondanks dergelijke inspanningen, de noodzaak om dure metaalkatalysatoren te gebruiken om elektrochemische activiteit op te wekken is blijven bestaan.
Gezien het gebrek aan vooruitgang, Gallant wilde iets anders proberen. "We waren geïnteresseerd in het proberen om een nieuwe chemie op het probleem toe te passen, " zegt ze. En daarbij de hulp inroepen van de sorptiemoleculen die CO . zo effectief opvangen 2 in CCS leek een veelbelovende manier om te gaan.
amine heroverwegen
Het sorbensmolecuul dat in CCS wordt gebruikt, is een amine, een derivaat van ammoniak. In CCS, uitlaat wordt door een aminebevattende oplossing geborreld, en het amine bindt chemisch de CO 2 , verwijderen uit de uitlaatgassen. de CO 2 - nu in vloeibare vorm - wordt vervolgens gescheiden van het amine en weer omgezet in een gas voor verwijdering.

Afstudeerstudent Aliza Khurram bereidt zich voor op experimenten door koolstofdioxide door een elektrochemische cel te pompen die bestaat uit lithium- en koolstofelektroden plus een speciaal ontworpen elektrolyt. Credit:Stuart Darsch
In CCS, die laatste stappen vereisen hoge temperaturen, die worden bereikt met behulp van een deel van de elektrische output van de elektriciteitscentrale. Gallant vroeg zich af of haar team in plaats daarvan elektrochemische reacties zou kunnen gebruiken om de CO . te scheiden 2 van het amine - en zet dan de reactie voort om een vaste stof te maken, CO 2 -bevattend product. Als, het verwijderingsproces zou eenvoudiger zijn dan voor gasvormig CO 2 . de CO 2 dichter opeengepakt zou zijn, dus het zou minder ruimte in beslag nemen, en het kon niet ontsnappen, dus het zou veiliger zijn. Nog steeds beter, extra elektrische energie kan aan het apparaat worden onttrokken terwijl het ontlaadt en het vaste materiaal vormt. "De visie was om een batterijachtig apparaat in de afvalstroom van de energiecentrale te plaatsen om de opgevangen CO . op te vangen 2 in een stabiele vaste stof, tijdens het oogsten van de energie die vrijkomt bij het proces, ' zegt Gallant.
Onderzoek naar CCS-technologie heeft geleid tot een goed begrip van het koolstofafvangproces dat plaatsvindt in een CCS-systeem. Wanneer CO 2 wordt toegevoegd aan een amine-oplossing, moleculen van de twee soorten spontaan combineren om een "adduct, " een nieuwe chemische soort waarin de oorspronkelijke moleculen grotendeels intact blijven. In dit geval het adduct vormt zich wanneer een koolstofatoom in een CO 2 molecuul bindt zich chemisch met een stikstofatoom in een aminemolecuul. Als ze combineren, de CO 2 molecuul is opnieuw geconfigureerd:het verandert van zijn oorspronkelijke, zeer stabiel, lineaire vorm tot een "gebogen" vorm met een negatieve lading - een zeer reactieve vorm die klaar is voor verdere reactie.
In haar schema Gallant stelde voor om elektrochemie te gebruiken om de CO . uit elkaar te halen 2 -amine-adduct - precies bij de koolstof-stikstofbinding. Het adduct bij die binding splitsen zou de twee stukken scheiden:het amine in zijn oorspronkelijke, niet-gereageerde staat, klaar om meer CO . af te vangen 2 , en de gebogen, chemisch reactieve vorm van CO 2 , die dan zouden kunnen reageren met de elektronen en positief geladen lithiumionen die stromen tijdens het ontladen van de batterij. Het resultaat van die reactie zou de vorming van lithiumcarbonaat (Li 2 CO 3 ), die zich op de koolstofelektrode zouden afzetten.
Tegelijkertijd, de reacties op de koolstofelektrode zouden de elektronenstroom tijdens het ontladen van de batterij moeten bevorderen, zelfs zonder een metaalkatalysator. "De ontlading van de batterij zou spontaan gebeuren, "zegt Gallant. "En we zouden het adduct breken op een manier die ons in staat stelt onze CO . te vernieuwen 2 absorber tijdens het nemen van CO 2 naar een stal, vaste vorm."
Een proces van ontdekking
in 2016, Gallant en doctoraalstudent werktuigbouwkunde Aliza Khurram begonnen dat idee te onderzoeken.
Hun eerste uitdaging was om een nieuwe elektrolyt te ontwikkelen. Een lithium-CO 2 batterij bestaat uit twee elektroden - een anode van lithium en een kathode van koolstof - en een elektrolyt, een oplossing die helpt geladen deeltjes heen en weer tussen de elektroden te transporteren terwijl de batterij wordt opgeladen en ontladen. Voor hun systeem ze hadden een elektrolyt nodig gemaakt van amine plus gevangen CO 2 opgelost in een oplosmiddel - en het moest chemische reacties op de koolstofkathode bevorderen terwijl de batterij ontlaadde.
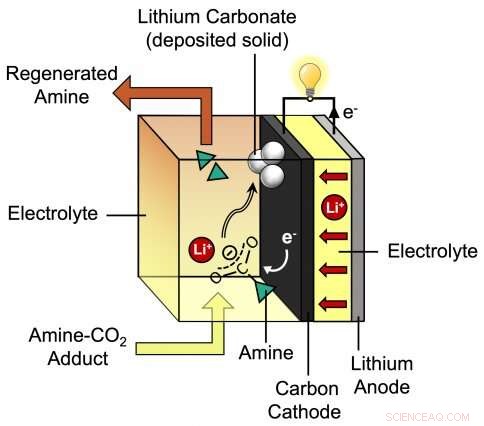
Dit diagram toont het proces tijdens het ontladen van de nieuwe lithium-CO2-batterij die is ontwikkeld door MIT-assistent-professor Betar Gallant en haar groep. De door de onderzoekers voorgestelde batterij bestaat uit een lithiumanode plus een koolstofkathode die is omgeven door een speciale elektrolyt die lithiumionen (Li+) en amine bevat. Krediet:Massachusetts Institute of Technology
Ze begonnen met het testen van mogelijke oplosmiddelen. Ze mengden hun CO 2 -Amine absorberen met een reeks oplosmiddelen die vaak in batterijen worden gebruikt en vervolgens CO .-borrelen 2 door de resulterende oplossing om te zien of CO 2 in deze onconventionele chemische omgeving in hoge concentraties kunnen worden opgelost. Geen van de amine-oplosmiddeloplossingen vertoonde waarneembare veranderingen wanneer de CO 2 werd geïntroduceerd, wat suggereert dat ze allemaal levensvatbare oplosmiddelkandidaten kunnen zijn.
Echter, om elk elektrochemisch apparaat te laten werken, de elektrolyt moet worden verrijkt met een zout om positief geladen ionen te leveren. Omdat het een lithiumbatterij is, de onderzoekers begonnen met het toevoegen van een op lithium gebaseerd zout - en de experimentele resultaten veranderden drastisch. Met de meeste solvabele kandidaten, het toevoegen van het zout zorgde er onmiddellijk voor dat het mengsel ofwel vaste precipitaten vormde of zeer stroperig werd - resultaten die hen uitsloten als levensvatbare oplosmiddelen. De enige uitzondering was het oplosmiddel dimethylsulfoxide, of DMSO. Zelfs toen het lithiumzout aanwezig was, de DMSO kan het amine en CO . oplossen 2 .
"We ontdekten dat - toevallig - het op lithium gebaseerde zout belangrijk was om de reactie te laten verlopen, " zegt Gallant. "Er is iets met het positief geladen lithium-ion dat chemisch coördineert met het amine-CO 2 adduct, en samen vormen die soorten de elektrochemisch reactieve soort."
Onderzoek naar het gedrag van de batterij tijdens het ontladen
Om het ontladingsgedrag van hun systeem te onderzoeken, zetten de onderzoekers een elektrochemische cel op bestaande uit een lithiumanode, een koolstofkathode, en hun speciale elektrolyt - voor de eenvoud, al geladen met CO 2 . Vervolgens volgden ze het ontladingsgedrag aan de koolstofkathode.
Zoals ze hadden gehoopt, hun speciale elektrolyt bevorderde in feite de ontladingsreactie in de testcel. "Met de amine opgenomen in de op DMSO gebaseerde elektrolyt samen met het lithiumzout en de CO 2 , we zien zeer hoge capaciteiten en aanzienlijke ontlaadspanningen - bijna drie volt, " zegt Gallant. Op basis van die resultaten, ze concludeerden dat hun systeem functioneert als een lithium-CO 2 batterij met capaciteiten en ontlaadspanningen die concurrerend zijn met die van de modernste lithium-gasbatterijen.
De volgende stap was om te bevestigen dat de reacties inderdaad het amine van de CO . scheidden 2 en het verder voortzetten van de reactie om CO . te maken 2 - afgeleide producten. Er achter komen, de onderzoekers gebruikten verschillende hulpmiddelen om de producten te onderzoeken die zich op de koolstofkathode vormden.

Deze scanning-elektronenmicroscoop (SEM)-afbeelding toont de kathode uit het lithium-kooldioxidesysteem van de onderzoekers na ontlading. Analyse van de bolvormige structuren bevestigt dat ze zijn samengesteld uit Li2CO3. De inzet toont een SEM-beeld van de koolstofkathode vóór ontlading. De afwezigheid van de bollen bevestigt dat ze tijdens de ontlading zijn gevormd. Krediet:Massachusetts Institute of Technology
In een proef, ze produceerden afbeeldingen van het kathodeoppervlak na de reactie met behulp van een scanning elektronenmicroscoop (SEM). Meteen duidelijk waren bolvormige formaties met een karakteristieke grootte van 500 nanometer, regelmatig verdeeld over het oppervlak van de kathode. Volgens Gallant, de waargenomen bolvormige structuur van het ontladingsproduct was vergelijkbaar met de vorm van Li 2 CO 3 waargenomen in andere op lithium gebaseerde batterijen. Die bollen waren niet duidelijk in SEM-afbeeldingen van de "ongerepte" koolstofkathode die werden genomen voordat de reacties plaatsvonden.
Andere analyses bevestigden dat de vaste stof die op de kathode was afgezet Li . was 2 CO 3 . Het omvatte alleen CO 2 -afgeleide materialen; er waren geen aminemoleculen of daarvan afgeleide producten aanwezig. Bij elkaar genomen, die gegevens leveren sterk bewijs dat de elektrochemische reductie van de CO 2 -geladen amine vindt plaats door de selectieve splitsing van de koolstof-stikstofbinding.
"Van het amine kan worden gedacht dat het effectief de reactiviteit van de CO . inschakelt 2 , ", zegt Gallant. "Dat is spannend omdat het amine dat veel wordt gebruikt in CO 2 capture kan dan twee cruciale functies vervullen. Het kan dienen als de absorber, spontaan CO . ophalen 2 uit verbrandingsgassen en door het in de elektrolytoplossing op te nemen. En het kan de CO . activeren 2 voor verdere reacties die niet mogelijk zouden zijn als de amine er niet was."
Toekomstige richtingen
Gallant benadrukt dat het werk tot nu toe slechts een proof-of-concept-studie is. "Er is nog veel fundamentele wetenschap te begrijpen, " ze zegt, voordat de onderzoekers hun systeem kunnen optimaliseren.
Zij en haar team blijven de chemische reacties onderzoeken die plaatsvinden in de elektrolyt, evenals de chemische samenstelling van het adduct dat zich vormt - de "reactanttoestand" waarop de daaropvolgende elektrochemie wordt uitgevoerd. Ze onderzoeken ook de gedetailleerde rol van de zoutsamenstelling.
In aanvulling, er zijn praktische zorgen waarmee ze rekening moeten houden als ze nadenken over het ontwerp van het apparaat. Een hardnekkig probleem is dat de vaste afzetting de koolstofkathode snel verstopt, dus verdere chemische reacties kunnen niet plaatsvinden. In één configuratie die ze onderzoeken - een ontwerp van een oplaadbare batterij - wordt de kathode blootgelegd tijdens elke ontlaad-laadcyclus. Reacties tijdens de ontlading deponeren de vaste Li 2 CO 3 , en reacties tijdens het opladen til hem op, zetten de lithiumionen en CO 2 terug in de elektrolyt, klaar om te reageren en meer elektriciteit op te wekken. Echter, de gevangen CO 2 bevindt zich dan weer in zijn oorspronkelijke gasvorm in de elektrolyt. Het verzegelen van de batterij zou die CO . vergrendelen 2 binnenkant, weg van de atmosfeer - maar slechts zo veel CO 2 kan worden opgeslagen in een bepaalde batterij, dus de algehele impact van het gebruik van batterijen om CO . af te vangen 2 emissies zouden in dit scenario beperkt zijn.

Met deze opstelling testen de onderzoekers de opslagcapaciteit en ontlaadspanning van hun batterijen. Credit:Stuart Darsch
De tweede configuratie die de onderzoekers onderzoeken - een opstelling die alleen ontlading biedt - lost dat probleem op door de gasvormige CO . nooit toe te staan 2 hervormen. "Wij zijn werktuigbouwkundigen, dus waar we heel graag mee bezig zijn, is het ontwikkelen van een industrieel proces waarbij je op de een of andere manier mechanisch of chemisch de vaste stof kunt oogsten terwijl deze zich vormt, Gallant zegt. "Stel je voor dat je door mechanische trillingen voorzichtig de vaste stof van de kathode zou kunnen verwijderen, om het helder te houden voor aanhoudende reactie." Geplaatst in een uitlaatstroom, zo'n systeem zou continu CO . kunnen verwijderen 2 uitstoot, elektriciteit opwekken en misschien tegelijkertijd waardevolle vaste stoffen produceren.
Gallant en haar team werken nu aan beide configuraties van hun systeem. "We weten nog niet wat beter is voor toepassingen, " zegt ze. Terwijl ze gelooft dat praktische lithium-CO 2 batterijen zijn nog jaren weg, ze is enthousiast over de eerste resultaten, wat suggereert dat het ontwikkelen van nieuwe elektrolyten om CO . vooraf te activeren 2 kan leiden tot alternatieve CO 2 reactiepaden. En zij en haar groep zijn er al mee bezig.
Een van de doelen is om het lithium te vervangen door een metaal dat minder duur en rijker is. zoals natrium of calcium. Met startfinanciering van het MIT Energy Initiative, het team is al begonnen met het bekijken van een systeem op basis van calcium, een materiaal dat nog niet goed ontwikkeld is voor batterijtoepassingen. Als de calcium-CO 2 setup werkt zoals ze voorspellen, de vaste stof die wordt gevormd, zou calciumcarbonaat zijn - een soort gesteente dat nu veel wordt gebruikt in de bouwsector.
Ondertussen, Gallant en haar collega's zijn blij dat ze een nieuwe klasse van reacties hebben gevonden voor het afvangen en vastleggen van CO 2 . "CO 2 conversie is gedurende vele decennia uitgebreid bestudeerd, " ze zegt, "Dus we zijn verheugd om te denken dat we misschien iets anders hebben gevonden en ons een nieuw venster bieden om dit onderwerp te verkennen."
Dit verhaal is opnieuw gepubliceerd met dank aan MIT News (web.mit.edu/newsoffice/), een populaire site met nieuws over MIT-onderzoek, innovatie en onderwijs.
 Vingerafdrukken zoeken met een Black Light
Vingerafdrukken zoeken met een Black Light Exoskeletale microstructuur van extreem harde kokoskrabklauwen
Exoskeletale microstructuur van extreem harde kokoskrabklauwen Subtiele veranderingen in de chemische structuur kunnen de toxiciteit van geneesmiddelen beïnvloeden
Subtiele veranderingen in de chemische structuur kunnen de toxiciteit van geneesmiddelen beïnvloeden Onderzoekers melden nieuwe, efficiëntere katalysator voor watersplitsing
Onderzoekers melden nieuwe, efficiëntere katalysator voor watersplitsing Wetenschappers ontwikkelen kunstmatig fotosyntheseapparaat voor groenere ethyleenproductie
Wetenschappers ontwikkelen kunstmatig fotosyntheseapparaat voor groenere ethyleenproductie
Hoofdlijnen
- Aanvallen van rupsen zorgen ervoor dat bladluizen planten kunnen besluipen
- Wat zijn de speciale dingen die gebeuren wanneer cellen worden gesplitst?
- Hoe de cellen van planten, dieren en eencellige organismen te vergelijken
- Nieuwe minimaal invasieve procedure redt het leven van honden - en haar nier
- Eerste uitgebreide inventarisatie van Neotropische slangen
- Sonic Kayaks:Milieumonitoring en experimentele muziek door burgers
- Waarom kan je jezelf niet kietelen?
- De voordelen van het bestuderen van cellen onder een lichtmicroscoop
- Genmutatie: definitie, oorzaken, typen, voorbeelden
- OLED's worden helderder en duurzamer

- Onderzoekers ontwikkelen nieuwe moleculaire ferro-elektrische metamaterialen

- Nieuwe studie stelt ongebruikelijke forensische onderzoekstechniek op de proef

- Onderzoekers ontwikkelen baanbrekende röntgentechniek om oude artefacten te analyseren

- Oorsprong van het leven in membraanloze protocellen

 Van chemische reactie tot levende cellen - wat was het begin van de ontwikkeling van het vroege leven op aarde?
Van chemische reactie tot levende cellen - wat was het begin van de ontwikkeling van het vroege leven op aarde? Hoe asymmetrische allianties de prestaties en het risico van een bedrijf beïnvloeden
Hoe asymmetrische allianties de prestaties en het risico van een bedrijf beïnvloeden Het is het beste om niet naar conferenties te vliegen
Het is het beste om niet naar conferenties te vliegen Voordelen van embryonale stamcelonderzoek
Voordelen van embryonale stamcelonderzoek Verbeterde 3D-nanoprinttechniek om nanoskyscrapers te bouwen
Verbeterde 3D-nanoprinttechniek om nanoskyscrapers te bouwen Hoe een Galileo-thermometer te lezen
Hoe een Galileo-thermometer te lezen  Metalen samenstelling van munten
Metalen samenstelling van munten  Onderzoek vindt dat een nieuw mentormodel de ondervertegenwoordigde faculteit voor minderheidsvrouwen in STEM ondersteunt
Onderzoek vindt dat een nieuw mentormodel de ondervertegenwoordigde faculteit voor minderheidsvrouwen in STEM ondersteunt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

