
Wetenschap
Nieuwe software brengt cryo-EM-kaarten met een lagere resolutie in beeld
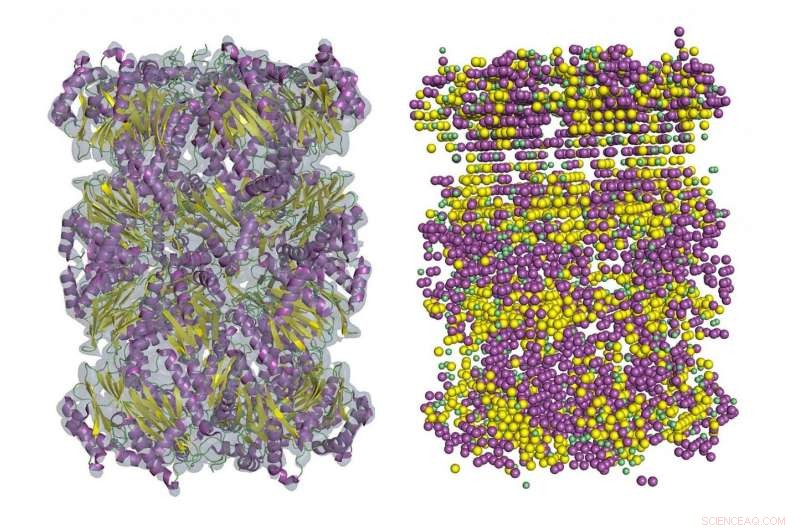
Een voorbeeld van de secundaire structuurdetectie in cryo-EM-dichtheidskaart met behulp van Emap2Sec. Links is een EM-kaart van archaeaal 20S-proteasoom (EMDB ID:EMD-1733). Rechts worden secundaire structuren gedetecteerd door Emap2Sec. Punten in magenta zijn de posities van gedetecteerde alfa-helices; gele punten zijn gedetecteerde bètastrengen, en groene punten zijn voor gedetecteerde spoelen (andere structuren). Krediet:Purdue University-afbeelding / Daisuke Kihara
Cryo-elektronenmicroscopie is nu de meest populaire methode voor het bepalen van eiwitstructuren, die onderzoekers helpt bij het ontwikkelen van medicijnen voor verschillende soorten aandoeningen. In de afgelopen decennia, het heeft röntgenkristallografie vervangen omdat het eiwitten kan afbeelden die niet gemakkelijk tot grote kristallen kunnen worden gevormd. De nieuwe techniek was zo revolutionair dat het zijn ontwikkelaars de Nobelprijs voor scheikunde 2017 opleverde.
Het eindproduct van cryo-EM is een kaart van de dichtheid van atomen in biologische moleculen, maar om het detailniveau te bereiken dat onderzoekers nodig hebben, ze moeten verdere analyses uitvoeren. Een nieuwe studie in het tijdschrift Natuurmethoden schetst een techniek om kaarten met een lage resolutie op peil te brengen.
De aanpak die onderzoekers daarbij gebruiken, hangt af van het detailniveau waarmee ze beginnen. Kaarten op 2 tot 3 ångström (Å, een lengte-eenheid die wordt gebruikt om de grootte van atomen en moleculen uit te drukken) worden over het algemeen als een hoge resolutie beschouwd. Echter, kaarten van deze kwaliteit zijn moeilijk te realiseren, en velen worden nog steeds algemeen geproduceerd in het bereik van 4 tot 10 . Van alle eiwitten die van 2016-18 zijn gedeponeerd in de Electron Microscopy Data Bank, meer dan 50% werd opgelost met een gemiddelde resolutie.
"Als de resolutie beter is dan drie, dan kunnen conventionele hulpmiddelen de aminozuurpositie traceren en een kaart van atoomposities bouwen. Maar vaak kan cryo-EM je geen 3 kaart geven, " zei Daisuke Kihara, een professor in biologische wetenschappen en informatica aan de Purdue University. "In kaarten van 5 Å of lager, je kunt meestal helemaal geen ketenconnectiviteit zien."
Eiwitten zijn eigenlijk ketens van aminozuren, en binding tussen aminogroepen en carboxylgroepen creëert soms bepaalde vouwpatronen. Deze patronen, bekend als alfa-helices en beta-strengen, vormen de secundaire structuur van het eiwit.
In kaarten van 5 tot 8 Å, sommige fragmenten van de secundaire structuur van eiwitten zijn meestal zichtbaar, maar het zou erg moeilijk zijn om de hele keten te traceren. Kihara's nieuwe methode, bekend als Emap2sec, onthult secundaire structuren in kaarten van 6 tot 10 Å.
Emap2sec heeft een diep convolutief neuraal netwerk in de kern van zijn algoritme. Deze netwerken zijn deep learning-systemen die voornamelijk worden gebruikt om afbeeldingen, cluster ze op gelijkenis en voer objectherkenning uit. Het werkt voor identificatie van eiwitstructuren in 3D-kaarten omdat de methode lokale kaartdichtheidskenmerken "convolueert" naar afbeeldingen van een groter gebied terwijl de informatie door lagen van neuraal netwerk gaat. De lokale voorspelling wordt gedaan in de context van een groot gebied van de kaart.
Geïdentificeerde secundaire structuren in 3D-kaarten helpen onderzoekers om bekende structuren van eiwitten die al in de kaart zijn opgelost, toe te wijzen. Daardoor hebben ze soms een uitgangspunt, of op zijn minst een idee van hoe een deel van de structuur eruit ziet. Emap2sec kan onderzoekers helpen hun stukje sneller en gemakkelijker in de puzzel te passen. De geïdentificeerde structuurinformatie kan ook nuttig zijn bij het vinden van fouten in structuurmodellering.
 Comet inspireert chemie voor het maken van ademende zuurstof op Mars
Comet inspireert chemie voor het maken van ademende zuurstof op Mars De uitdaging om koolstof op te vangen
De uitdaging om koolstof op te vangen Onderzoekers stellen nieuwe lat voor watersplitsing, CO2-splitsingstechnieken
Onderzoekers stellen nieuwe lat voor watersplitsing, CO2-splitsingstechnieken Vooruitgang in jacht op onbekende verbindingen in drinkwater
Vooruitgang in jacht op onbekende verbindingen in drinkwater Mechanisme voor hMTH1s brede substraatspecificiteit onthuld
Mechanisme voor hMTH1s brede substraatspecificiteit onthuld
 Temidden van roep om voorgeschreven brandwonden te verhogen, obstakels wachten op
Temidden van roep om voorgeschreven brandwonden te verhogen, obstakels wachten op Klimaatverandering als gevolg van rook van nucleaire oorlogen kan de wereldwijde voedselvoorziening bedreigen, menselijke gezondheid
Klimaatverandering als gevolg van rook van nucleaire oorlogen kan de wereldwijde voedselvoorziening bedreigen, menselijke gezondheid gesmolten asfalt, schoenen voor honden:Europa verwelkt in hitte
gesmolten asfalt, schoenen voor honden:Europa verwelkt in hitte Geologen graven in de mysterieuze kloof van Grand Canyons in de tijd
Geologen graven in de mysterieuze kloof van Grand Canyons in de tijd Hoe klimaatverandering het immuunsysteem van koraal verzwakt
Hoe klimaatverandering het immuunsysteem van koraal verzwakt
Hoofdlijnen
- Maakt Koud U Slaperig?
- Biologen op het spoor van hersenetende amoeben
- De oproepen van pinguïns worden beïnvloed door hun leefgebied
- Hoe planten hun zaden vormen
- Mannelijke dolfijnen bieden geschenken aan om vrouwtjes aan te trekken
- Hoeveelheid water in stamcellen kan zijn lot bepalen als vet of bot
- Hoe elektroforese werkt
Elektroforese is een proces dat door wetenschappers wordt gebruikt om te helpen begrijpen welke fragmenten van DNA ze onderzoeken. Dit kan helpen bij het identificeren van verschillend DNA voor strafzaken, in diagnostische g
- Wat is de regeling in de microbiologie?
- Hoe kan iemand 11 dagen wakker blijven?
- Nieuw membraan kan de weg vrijmaken voor goedkope, efficiënt gemaakte biobrandstoffen

- Onderzoekers melden nieuwe, efficiëntere katalysator voor watersplitsing

- Onderzoekers ontdekken C-H-bindingsactiveringsreacties bij lage temperatuur door foto-geïnduceerde middelen
- Wetenschappers hebben een materiaal ontwikkeld voor het nieuwe type liquid crystal displays
- Onderzoeksresultaten maken de weg vrij voor programmeerbare elektronische inkten

 Wetenschappers construeren zeer sterke microbuis door coaxiaal printen met aangepaste biohybird hydrogel-inkt
Wetenschappers construeren zeer sterke microbuis door coaxiaal printen met aangepaste biohybird hydrogel-inkt Hoe te berekenen Momentane Rate
Hoe te berekenen Momentane Rate  Eerste Amerikaanse experimenten ooit in nieuwe röntgenfaciliteit kunnen leiden tot betere modellering van explosieven
Eerste Amerikaanse experimenten ooit in nieuwe röntgenfaciliteit kunnen leiden tot betere modellering van explosieven Wiskundige analyse verklaart door transpiratie aangedreven sapstroom in naaldbomen
Wiskundige analyse verklaart door transpiratie aangedreven sapstroom in naaldbomen Hoe Chupacabras werken
Hoe Chupacabras werken  Een ijstijd van 115, 000 jaar in twee minuten
Een ijstijd van 115, 000 jaar in twee minuten Vrouwelijke mangoesten helpen hun pups door rivalen te verdrijven
Vrouwelijke mangoesten helpen hun pups door rivalen te verdrijven Chemici ontwikkelen een nieuw milieuvriendelijk materiaal voor afvalwaterzuivering
Chemici ontwikkelen een nieuw milieuvriendelijk materiaal voor afvalwaterzuivering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

