
Wetenschap
Onderzoek onderzoekt samenspel van eiwitten bij diabetes type 2

Krediet:CC0 Publiek Domein
Een kenmerk van ouderdomsziekten zoals de ziekte van Parkinson, type 2 diabetes, of de ziekte van Alzheimer is de abnormale samenklontering van eiwitten in cellen. Bij mensen met deze aandoeningen deze eiwitklonten kunnen resulteren in onregelmatige afzettingen die bekend staan als amyloïden en die het normale celgedrag verstoren. Een patholoog van Yale ontdekte onlangs dat deze interacties dramatisch kunnen worden verminderd bij diabetes type 2 wanneer kleine hoeveelheden naburige eiwitten aanwezig zijn.
Om deze interacties op moleculair niveau te begrijpen, assistent-professor en hoofdauteur Zachary Levine en zijn medewerkers voerden een reeks simulaties uit die onthulden hoe amyloïden worden gevormd. Ze ontdekten dat een unieke eiwitbuur, gewoonlijk elders in de cel aangetroffen, was in staat om de amyloïden gevonden bij diabetes type 2 met zeer hoge precisie te stabiliseren. Deze interacties werden vervolgens geverifieerd in verdere experimenten, wat suggereert dat het lichaam amyloïde ziekten zou kunnen reguleren met behulp van een cocktail van stabiliserende eiwitten.
Deze ontdekking benadrukt belangrijke interacties tussen amyloïde-eiwitten en andere kleine moleculen die wetenschappers kunnen nabootsen met behulp van synthetische verbindingen, zei Levine. Aangenomen wordt dat deze waarnemingen niet uniek zijn voor diabetes, hij merkte, wat suggereert dat meerdere amyloïde ziekten het doelwit kunnen zijn, en mogelijk behandeld, op een soortgelijke manier. De studie is gepubliceerd en staat op de omslag van de Tijdschrift van de American Chemical Society
 Kunnen we plastic tassen recyclen tot stoffen van de toekomst?
Kunnen we plastic tassen recyclen tot stoffen van de toekomst? Digitaliseren en repliceren van de wereld van materialen
Digitaliseren en repliceren van de wereld van materialen Cryo-elektronenmicroscopie bereikt ongekende resolutie met behulp van nieuwe rekenmethoden
Cryo-elektronenmicroscopie bereikt ongekende resolutie met behulp van nieuwe rekenmethoden Hoog-entropie-gestabiliseerde chalcogeniden met hoge thermo-elektrische prestaties
Hoog-entropie-gestabiliseerde chalcogeniden met hoge thermo-elektrische prestaties Kunstmatige intelligentie kan wetenschappers helpen bij het maken van spray-on zonnecellen
Kunstmatige intelligentie kan wetenschappers helpen bij het maken van spray-on zonnecellen
 De ontdekking van een effectievere methode om vervuilende emissies van stikstofmeststoffen in te schatten
De ontdekking van een effectievere methode om vervuilende emissies van stikstofmeststoffen in te schatten Ellende, onzekerheid nadat Irma de idylle van Florida bereikt
Ellende, onzekerheid nadat Irma de idylle van Florida bereikt IJstijdthermostaat verhinderde extreme klimaatkoeling
IJstijdthermostaat verhinderde extreme klimaatkoeling Doorbraak in debat over recente toename methaan in de atmosfeer
Doorbraak in debat over recente toename methaan in de atmosfeer 300 miljoen deltabewoners kwetsbaar voor cyclonen, overstroming
300 miljoen deltabewoners kwetsbaar voor cyclonen, overstroming
Hoofdlijnen
- Roodbuikmaki's behouden de darmgezondheid door elkaar aan te raken en tegen elkaar aan te kruipen
- Onderzoeker onthult hoe kevers terugveren van bosbranden
- Zelfgemaakte UV-sterilisator
- 'Welke dag is het ook alweer?' De psychologie van dinsdag
- Wat is Lambda Max?
- Namen van de Enzymen in de Mond & Esophagus
- Onderzoekers identificeren genen die zoogdieren van andere dieren onderscheiden
- "The Theory of Biogenesis
- Verschil tussen een gesloten en open bloedsomloop
- Zonnebrandstoffen werken goed onder druk

- Gouden microjuwelen uit de 3D-printer

- Schilderen met halfgeleiders

- Groene katalysatoren met aardrijke metalen versnellen de productie van biobased plastic
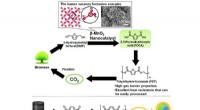
- Wetenschappers ontwikkelen goedkope chip om aanwezigheid en hoeveelheid COVID-19-antilichamen te detecteren

 Wilde storm doodt 3, bevuilt het water in Melbourne, Australië
Wilde storm doodt 3, bevuilt het water in Melbourne, Australië Aardbeving met een kracht van 4,5 op de schaal van Richter gevoeld in Bulgaarse hoofdstad
Aardbeving met een kracht van 4,5 op de schaal van Richter gevoeld in Bulgaarse hoofdstad Onderzoek identificeert een andere verklaring voor de huwelijkspremie voor nakomelingen
Onderzoek identificeert een andere verklaring voor de huwelijkspremie voor nakomelingen Berekening van het feitelijke mechanische voordeel
Berekening van het feitelijke mechanische voordeel Lijst met langhalsdinosaurussen
Lijst met langhalsdinosaurussen Naar de maan en terug:50 jaar later, een grote sprong in het onbekende
Naar de maan en terug:50 jaar later, een grote sprong in het onbekende NASA heeft de regenval van Typhoon Prapiroons opgeteld
NASA heeft de regenval van Typhoon Prapiroons opgeteld Ecologische ramp gevreesd terwijl Griekenland bosbrand bestrijdt
Ecologische ramp gevreesd terwijl Griekenland bosbrand bestrijdt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Swedish | Norway |

-
Wetenschap © https://nl.scienceaq.com

