
Wetenschap
De ecologische voetafdruk van een chemische stof in alledaagse voorwerpen verkleinen
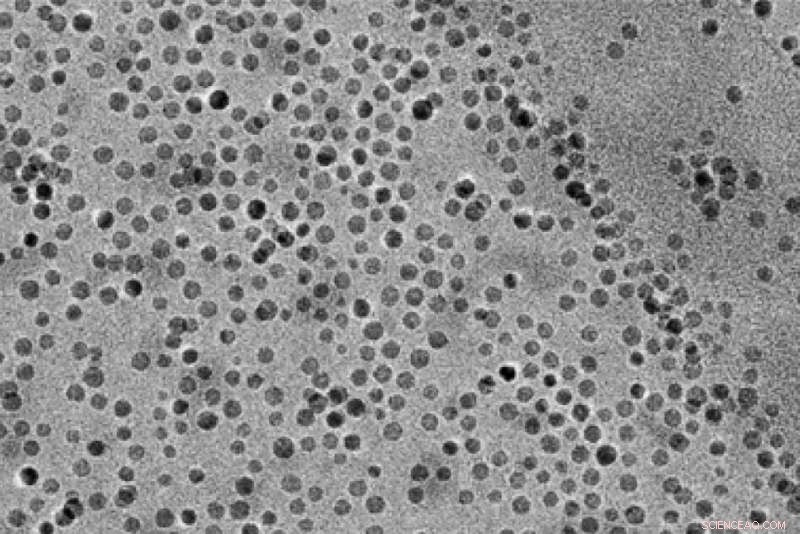
MIT-onderzoekers gebruikten deze mangaanoxide-nanodeeltjes om de afbraak van water en de daaropvolgende opname van zuurstof in bruikbare verbindingen die epoxiden worden genoemd, te katalyseren. Credit:onderzoekers/MIT
De grootste bron van wereldwijd energieverbruik is de industriële productie van producten zoals kunststoffen, ijzer, en staal. Het vervaardigen van deze materialen vereist niet alleen enorme hoeveelheden energie, maar veel van de reacties stoten ook direct koolstofdioxide uit als bijproduct.
In een poging om dit energieverbruik en de bijbehorende emissies te helpen verminderen, Chemische ingenieurs van het MIT hebben een alternatieve benadering bedacht voor het synthetiseren van epoxiden, een soort chemische stof die wordt gebruikt om diverse producten te vervaardigen, inclusief kunststoffen, geneesmiddelen, en textiel. Hun nieuwe aanpak, die elektriciteit gebruikt om de reactie te laten verlopen, kan worden gedaan bij kamertemperatuur en atmosferische druk terwijl kooldioxide als bijproduct wordt geëlimineerd.
"Wat niet vaak wordt gerealiseerd, is dat industrieel energieverbruik veel groter is dan vervoer of huishoudelijk gebruik. Dit is de olifant in de kamer, en er is zeer weinig technische vooruitgang geboekt in termen van het kunnen verminderen van het industriële energieverbruik, " zegt Karthish Manthiram, een assistent-professor chemische technologie en de senior auteur van de nieuwe studie.
De onderzoekers hebben patent aangevraagd op hun techniek, en ze werken nu aan het verbeteren van de efficiëntie van de synthese, zodat deze kan worden aangepast voor grootschalige, industrieel gebruik.
MIT-postdoc Kyoungsuk Jin is de hoofdauteur van het artikel, die op 9 april online verschijnt in de Tijdschrift van de American Chemical Society . Andere auteurs zijn onder meer afgestudeerde studenten Joseph Maalouf, Nikifar Lazouski, en Nathan Corbin, en postdoc Dengtao Yang.
alomtegenwoordige chemicaliën
epoxiden, waarvan het belangrijkste chemische kenmerk een drieledige ring is die bestaat uit een zuurstofatoom gebonden aan twee koolstofatomen, worden gebruikt om producten te maken die zo gevarieerd zijn als antivries, wasmiddelen, en polyester.
"Het is onmogelijk om zelfs maar een korte periode van je leven te gaan zonder iets aan te raken, te voelen of te dragen dat op een bepaald moment in de geschiedenis een epoxide bevatte. Ze zijn alomtegenwoordig, " zegt Manthiram. "Ze zijn op zoveel verschillende plaatsen, maar we hebben de neiging om niet na te denken over de ingebedde energie- en koolstofdioxidevoetafdruk."
Verschillende epoxiden behoren tot de chemicaliën met de grootste koolstofvoetafdruk. De productie van één gemeenschappelijk epoxide, ethyleenoxide, genereert de op vier na grootste CO2-uitstoot van alle chemische producten.
De productie van epoxiden vereist veel chemische stappen, en de meeste zijn erg energie-intensief. Bijvoorbeeld, de reactie die wordt gebruikt om een zuurstofatoom aan ethyleen te hechten, de productie van ethyleenoxide, moet worden gedaan bij bijna 300 graden Celsius en onder een druk die 20 keer groter is dan de atmosferische druk. Verder, de meeste energie die wordt gebruikt om dit soort productie aan te drijven, is afkomstig van fossiele brandstoffen.
Toe te voegen aan de ecologische voetafdruk, de reactie die wordt gebruikt om ethyleenoxide te produceren, genereert ook koolstofdioxide als bijproduct, die in de atmosfeer terechtkomt. Andere epoxiden worden gemaakt met behulp van een meer gecompliceerde benadering met gevaarlijke peroxiden, die explosief kunnen zijn, en calciumhydroxide, die huidirritatie kunnen veroorzaken.
Om tot een duurzamere aanpak te komen, het MIT-team liet zich inspireren door een reactie die bekend staat als wateroxidatie, die elektriciteit gebruikt om water in zuurstof te splitsen, protonen, en elektronen. Ze besloten om te proberen de wateroxidatie uit te voeren en vervolgens het zuurstofatoom te hechten aan een organische verbinding die een olefine wordt genoemd, wat een voorloper is van epoxiden.
Dit was een contra-intuïtieve benadering, Manthiram zegt, omdat olefinen en water normaal gesproken niet met elkaar kunnen reageren. Echter, ze kunnen met elkaar reageren wanneer een elektrische spanning wordt aangelegd.
Om hiervan te profiteren, het MIT-team ontwierp een reactor met een anode waarin water wordt afgebroken tot zuurstof, waterstofionen (protonen), en elektronen. Mangaanoxide-nanodeeltjes werken als een katalysator om deze reactie te helpen, en om de zuurstof in een olefine op te nemen om een epoxide te maken. Protonen en elektronen stromen naar de kathode, waar ze worden omgezet in waterstofgas.
thermodynamisch, deze reactie vereist slechts ongeveer 1 volt elektriciteit, minder dan de spanning van een standaard AA-batterij. De reactie genereert geen koolstofdioxide, en de onderzoekers verwachten dat ze de koolstofvoetafdruk verder kunnen verkleinen door elektriciteit uit hernieuwbare bronnen zoals zon of wind te gebruiken om de epoxideconversie aan te drijven.
Opschalen
Tot dusver, de onderzoekers hebben aangetoond dat ze dit proces kunnen gebruiken om een epoxide te maken dat cyclo-octeenoxide wordt genoemd, en ze zijn nu bezig het aan te passen aan andere epoxiden. Ze proberen ook de omzetting van olefinen in epoxiden efficiënter te maken - in dit onderzoek ongeveer 30 procent van de elektrische stroom ging in de conversiereactie, maar ze hopen dat te verdubbelen.
Ze schatten dat hun proces, indien opgeschaald, zou ethyleenoxide kunnen produceren tegen een kostprijs van $ 900 per ton, vergeleken met $1, 500 per ton met de huidige methoden. Die kosten kunnen verder worden verlaagd naarmate het proces efficiënter wordt. Een andere factor die kan bijdragen aan de economische levensvatbaarheid van deze aanpak is dat het ook waterstof genereert als bijproduct, wat op zichzelf al waardevol is om brandstofcellen van stroom te voorzien.
De onderzoekers zijn van plan de technologie verder te ontwikkelen in de hoop deze uiteindelijk te commercialiseren voor industrieel gebruik. en ze werken ook aan het gebruik van elektriciteit om andere soorten chemicaliën te synthetiseren.
"Er zijn veel processen die enorme CO2-voetafdrukken hebben, en decarbonisatie kan worden aangedreven door elektrificatie, " zegt Manthiram. "Je kunt temperatuur elimineren, elimineer de druk, en in plaats daarvan spanning gebruiken."
 Milieuvriendelijk kooldioxide-conversieproces kan een revolutie teweegbrengen in de bestaande methode
Milieuvriendelijk kooldioxide-conversieproces kan een revolutie teweegbrengen in de bestaande methode Onderzoekers vinden een manier om farmacoterrorisme te bestrijden
Onderzoekers vinden een manier om farmacoterrorisme te bestrijden Hoe de gebalanceerde chemische reactie voor het roesten van Iron
Hoe de gebalanceerde chemische reactie voor het roesten van Iron Wetenschapsexperimenten met betrekking tot de kinetische moleculaire gassentheorie
Wetenschapsexperimenten met betrekking tot de kinetische moleculaire gassentheorie Nieuw materiaal op cellulosebasis vertegenwoordigt drie sensoren in één
Nieuw materiaal op cellulosebasis vertegenwoordigt drie sensoren in één
 NASA ziet verticale windschering van invloed op tropische storm Muifa
NASA ziet verticale windschering van invloed op tropische storm Muifa Weerbaarheid tegen klimaatverandering kan op de lange termijn biljoenen besparen, maar nu miljarden vinden om ervoor te betalen is het moeilijkste deel
Weerbaarheid tegen klimaatverandering kan op de lange termijn biljoenen besparen, maar nu miljarden vinden om ervoor te betalen is het moeilijkste deel Sedimenten op de oceaanbodem vertellen een verhaal over de oude Groenlandse zomers
Sedimenten op de oceaanbodem vertellen een verhaal over de oude Groenlandse zomers Soorten menselijke activiteiten die ecosystemen hebben vernietigd
Soorten menselijke activiteiten die ecosystemen hebben vernietigd  Fietsers in Londen gewaarschuwd dat 's avonds de meest vieze lucht heeft dus kies een schone route naar huis
Fietsers in Londen gewaarschuwd dat 's avonds de meest vieze lucht heeft dus kies een schone route naar huis
Hoofdlijnen
- Dissectie van één molecuul van ontwikkelingsgencontrole
- Your Brain On: An All Nighter
- Theorie van de evolutie van geslachten getest met algen
- Wat is de functie van de promotor in de transcriptie van DNA?
- Stamcellen die vetweefsel genereren, hebben een circadiane klok
- Wat zijn de voordelen van eiwitten die worden geproduceerd door middel van recombinante DNA-technologie?
- Migratie loont voor zangvogels
- Soorten genetische kruisen
- Zelfverdediging voor planten
- Team onthult katalysator die problematische CF-bindingen kan verbreken
- Cementvrij beton verslaat corrosie en geeft fatbergs de flush

- 3D-printen elektrisch ondersteund, op parelmoer geïnspireerde structuren met zelfgevoelige mogelijkheden
- Afbeelding:Plastic sparrenbos

- Een klein eiwit met veel toepassingen
 Meer dan de helft van de Amerikaanse studenten ervaart vijf jaar op rij leerverlies tijdens de zomer
Meer dan de helft van de Amerikaanse studenten ervaart vijf jaar op rij leerverlies tijdens de zomer Zuurstofreducerende enzymen begrijpen
Zuurstofreducerende enzymen begrijpen China's zero-waste activisten vechten tegen overconsumptie
China's zero-waste activisten vechten tegen overconsumptie Afbeelding:Hubble volgt de buitenste regionen van een sterrenstelsel
Afbeelding:Hubble volgt de buitenste regionen van een sterrenstelsel Wat zijn de voordelen van ecosystemen?
Wat zijn de voordelen van ecosystemen?  Huishoudelijk werk bijna gelijk voor jongens en meisjes
Huishoudelijk werk bijna gelijk voor jongens en meisjes Wat is secundaire oliewinning?
Wat is secundaire oliewinning?  5 Verbijsterende subatomaire deeltjes
5 Verbijsterende subatomaire deeltjes
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com

