
Wetenschap
Zuurstofreducerende enzymen begrijpen

Foto's van F420H2-oxidasekristallen die aëroob zijn verkregen met een typische grootte van 0,1 mm. Met zuurstof geven het Fe en flavine in het enzym de natuurlijke gele kleur aan de kristallen. Krediet:Max Planck Instituut voor Mariene Microbiologie/T. Wagner
Methaan is een krachtig broeikasgas dat een centrale rol speelt in de wereldwijde koolstofcyclus. Tegelijkertijd, het is een belangrijke energiebron voor ons mensen. Ongeveer de helft van de jaarlijkse productie wordt gemaakt door micro-organismen die bekend staan als methanogenen die organisch materiaal zoals dode planten afbreken. Dit gebeurt normaal gesproken in een habitat zonder zuurstof, aangezien dit gas dodelijk is voor methanogenen. Maar zelfs in feitelijk zuurstofvrije habitats, zuurstofmoleculen verschijnen af en toe. Om deze indringers onschadelijk te maken, methanogenen bezitten een speciaal enzym dat zuurstof in water kan omzetten.
"Enzymen zijn vitale componenten van het metabolisme van alle levende organismen en het doel van ons laboratorium is om te begrijpen hoe deze nanomachines werken op moleculair niveau, " zegt Tristan Wagner van het Max Planck Instituut voor Mariene Microbiologie en eerste auteur van de studie, gepubliceerd in het wetenschappelijke tijdschrift Chemische communicatie in september 2020. Voor het onderzoek, Wagner kweekte een anaëroob micro-organisme genaamd Methanothermococcus thermolithotrophicus, die afkomstig is uit het sediment van de Golf van Napels. Hij zuiverde het enzym F420-oxidase, een flavodiijzer-eiwit, en kristalliseerde het uit, een veelgebruikte methode om de werking van enzymen te bestuderen.
"Het was al bekend dat F420-oxidase zuurstof kan omzetten in water, ", zegt Wagner. "Maar we zijn erin geslaagd om het mechanisme te ontcijferen." De studie is een samenwerking van wetenschappers van het Max Planck Instituut voor Mariene Microbiologie, het Max Planck Instituut voor Terrestrische Microbiologie, het Paul Scherrer Instituut, het Interdisciplinair Onderzoeksinstituut van Grenoble en de European Synchrotron Radiation Facility.
Zuurstof zit opgesloten
Het mechanisme, onthulden de onderzoekers, heeft een belangrijke eis:zuurstof is zeer reactief, het is dus cruciaal dat de reactie correct wordt gecontroleerd door het enzym en dat er geen oplosmiddelen rondzweven. Anders kan de zuurstof per ongeluk worden omgezet in superoxide en de anaërobe doden. De truc van het enzym F420-oxidase is het gebruik van een gaskanaal en een poortsysteem. Het zuurstofmolecuul wordt eerst in het specifieke kanaal naar een geschikte watervrije katalytische holte geleid die ijzer bevat. Vervolgens zet ijzer de zuurstof om in water dat vrijkomt door een poortmechanisme. Daarvoor begint de holte te bewegen en opent een kleine "deur". Dankzij de beweging het nieuw opgewekte water wordt naar buiten getransporteerd. De lege holte sluit zich weer en is beschikbaar voor het volgende zuurstofmolecuul.
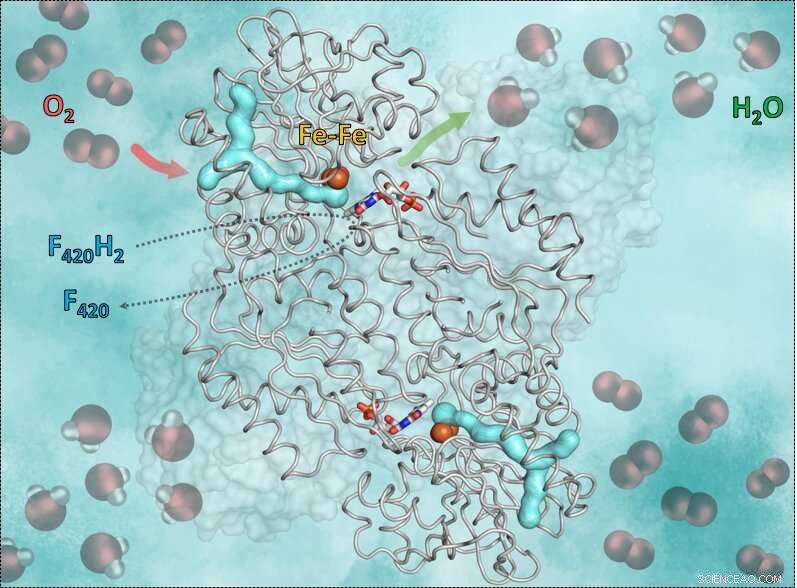
Deze afbeelding toont het enzym F420H2-Oxidase en de manier waarop het werkt. Het cyaan y-gevormde deel is het gaskanaal. De rode pijl geeft de weg aan van de zuurstof naar de katalytische holte die ijzer bevat. De groene pijl symboliseert de uitweg uit het water. Nog, de blauw-rode staafjes in het midden tonen de flavine (FMN) die elektronen accepteert van het gereduceerde co-enzym F420, die de waterstof brengt die nodig is om de zuurstof in water om te zetten. Krediet:S. Engilberge en T. Wagner
Om inzicht te krijgen in dit mechanisme gebruikten de wetenschappers röntgenkristallografie. Ze verkregen eerst de kristalstructuur zonder zuurstof, waar ze de watervrije katalytische holte konden zien, geïsoleerd van het oplosmiddel. Vervolgens, ze vergassen de enzymkristallen met het inerte gas krypton, die, in tegenstelling tot zuurstof, zichtbaar gemaakt kunnen worden met röntgenstralen. Daarna bestraalden ze de enzymkristallen en konden ze krypton-atomen detecteren die het gaskanaal lieten zien dat naar de katalytische holte leidde. Het flavodiiron-eiwit en zijn kanaal zijn niet alleen geconserveerd in methanogenen, maar ook in andere micro-organismen zoals clostridia (die voornamelijk in de bodem of in het spijsverteringskanaal leven), in de zwavelbacterie Desulfovibrio gigas of zelfs in de darmparasiet Giardia intestinalis.
Hoe sneller hoe beter
"Deze reactie is echt snel, " zegt Sylvain Engilberge van het Paul Scherrer Instituut en eerste auteur van de studie naast Tristan Wagner. "Deze snelheid is ook het grote belang van ons onderzoek." Vergelijkbare enzymen zoals laccase zijn veel langzamer. "Voor toekomstige toepassing van bio-geïnspireerde elektrochemische processen, we moeten meer leren van de chemische reactie, structuur en functie van verschillende groepen zuurstofreducerende enzymen, ", zegt Engilberge. Het zou ook de weg vrijmaken voor eiwittechnologie om een high-rate O2-detoxifier om te zetten in een elektronenput voor industriële processen.
"Onze volgende stap zou zijn om de diversiteit van flavodiiron-eiwit te begrijpen, ", zegt Tristan Wagner. Sommige homologen richten zich niet op zuurstof maar op het giftige stikstofmonoxide, hun enzymen kunnen onderscheid maken tussen beide gassen met een hoge specificiteit. Maar wat is het selectieve filter? Het gaskanaal? De omgeving van de katalytische holte? "Er moeten meer studies worden uitgevoerd om te begrijpen hoe het eiwit zuurstof en stikstofmonoxide discrimineert, ", voegt Wagner toe. Met zulke kennis, het zou bijvoorbeeld mogelijk zijn om op basis van genomische informatie te voorspellen of een flavodiiron-eiwit een zuurstof- of stikstofmonoxidevanger zou zijn.
 Catalyst opent deur naar efficiënter, milieuvriendelijke ethyleenproductie
Catalyst opent deur naar efficiënter, milieuvriendelijke ethyleenproductie Een mogelijk einde aan eeuwigdurende chemicaliën
Een mogelijk einde aan eeuwigdurende chemicaliën Wat zit er in een permanente marker?
Wat zit er in een permanente marker?  Virusoppervlakken helpen ingenieurs bij het bestuderen van toepassingen voor vaccins en gentherapie
Virusoppervlakken helpen ingenieurs bij het bestuderen van toepassingen voor vaccins en gentherapie Studie legt basis voor toekomstig medicijnontwerp
Studie legt basis voor toekomstig medicijnontwerp
 Californië zet zich schrap voor harde wind die dodelijke bosbranden kan veroorzaken
Californië zet zich schrap voor harde wind die dodelijke bosbranden kan veroorzaken Het verschil tussen ratten en wilde ratten
Het verschil tussen ratten en wilde ratten Extratropische vulkanen beïnvloeden het klimaat meer dan aangenomen
Extratropische vulkanen beïnvloeden het klimaat meer dan aangenomen Nieuw classificatiesysteem voor mineralen legt het complexe verleden van de aarde vast
Nieuw classificatiesysteem voor mineralen legt het complexe verleden van de aarde vast Het verhogen van het grondwaterpeil in landbouwveengebieden kan de sleutel zijn tot het verminderen van de uitstoot van broeikasgassen in het VK
Het verhogen van het grondwaterpeil in landbouwveengebieden kan de sleutel zijn tot het verminderen van de uitstoot van broeikasgassen in het VK
Hoofdlijnen
- Vogels zonder eigen broed helpen andere vogels met opvoeden, maar niet onbaatzuchtig
- Soorten organellen
- Nieuw onderzoek lost een van de meest verhitte geschillen over evolutionaire biologie op robuuste wijze op
- Habitat telt wanneer roofdieren op de loer liggen
- Wat zijn de twee belangrijkste functies van nucleïnezuur in levende wezens?
Nucleïnezuren zijn kleine stukjes materie met grote rollen om te spelen. Genoemd naar hun locatie - de kern - deze zuren dragen informatie die cellen helpt bij het maken va
- Massa-extincties verwijderen soorten, maar geen ecologische variëteit
- Organellen gevonden in beide planten- en bacteriecellen
- De evolutionaire oorsprong van de darm
- Nieuw ontwikkelde schakelaar activeert genen duizenden keren beter dan de natuur
- Onderzoekers rapporteren nieuwe toestand van materie beschreven als vloeibaar glas

- Bevindingen bevestigen het vermogen van beeldvormende technieken om gezond weefsel te onderscheiden na neoadjuvante chemotherapie
- Wat zijn Spectator-ionen?

- Fentanyl kan eerstehulpverleners ziek maken. Hier is een mogelijke oplossing

- Nieuw onderzoek biedt uitgebreide inzichten in de reactie van de hersenen op opioïden

 Vlindervleugel inspireert fotovoltaïsche energie:lichtabsorptie kan tot 200 procent worden verbeterd
Vlindervleugel inspireert fotovoltaïsche energie:lichtabsorptie kan tot 200 procent worden verbeterd Italië beboet Facebook voor het verkopen van gebruikersgegevens
Italië beboet Facebook voor het verkopen van gebruikersgegevens Minder grondbewerking helpt zowel de bodem als de opbrengst
Minder grondbewerking helpt zowel de bodem als de opbrengst WHO, Greta of perswaakhonden voor Nobelprijs voor de Vrede?
WHO, Greta of perswaakhonden voor Nobelprijs voor de Vrede? Cassini, Voyager-missies suggereren een nieuw beeld van de interactie van de zonnen met de melkweg
Cassini, Voyager-missies suggereren een nieuw beeld van de interactie van de zonnen met de melkweg Ouders, seksuele voorlichting begint thuis
Ouders, seksuele voorlichting begint thuis Ontbossing van Guyana Shield zal gevolgen hebben voor heel Zuid-Amerika, wetenschappers waarschuwen
Ontbossing van Guyana Shield zal gevolgen hebben voor heel Zuid-Amerika, wetenschappers waarschuwen 2D-materialen bieden unieke rekeigenschappen
2D-materialen bieden unieke rekeigenschappen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com

