
Wetenschap
Onderzoekers gebruiken jiggly Jell-O om krachtige nieuwe waterstofbrandstofkatalysator te maken

Tweedimensionale metaalcarbiden veroorzaken een reactie die water splitst in zuurstof en waardevol waterstofgas. Onderzoekers van Berkeley hebben een eenvoudig nieuw recept ontdekt voor het bereiden van deze nanometer-dunne vellen dat bijna net zo eenvoudig is als het maken van Jell-O uit een doos. Krediet:Xining Zang-afbeelding, copyright Wiley
Een goedkope en effectieve nieuwe katalysator ontwikkeld door onderzoekers van de Universiteit van Californië, Berkeley, kan waterstofbrandstof net zo efficiënt uit water halen als platina, momenteel de beste - maar ook duurste - watersplitsende katalysator die er is.
De katalysator, die is samengesteld uit nanometer-dunne platen van metaalcarbide, wordt vervaardigd met behulp van een zelfassemblageproces dat gebaseerd is op een verrassend ingrediënt:gelatine, het materiaal dat Jell-O zijn schok geeft.
"Platina is duur, dus het zou wenselijk zijn om andere alternatieve materialen te vinden om het te vervangen, " zei senior auteur Liwei Lin, hoogleraar werktuigbouwkunde aan UC Berkeley. "We gebruiken eigenlijk iets dat lijkt op de Jell-O die je als basis kunt eten, en het te mengen met enkele van de overvloedige aardelementen om een goedkoop nieuw materiaal te creëren voor belangrijke katalytische reacties."
Het werk verschijnt in de gedrukte editie van 13 december van het tijdschrift Geavanceerde materialen .
Een stroomstoot kan de sterke bindingen verbreken die watermoleculen aan elkaar binden, het creëren van zuurstof en waterstofgas, waarvan de laatste een uiterst waardevolle energiebron is voor de aandrijving van waterstofbrandstofcellen. Waterstofgas kan ook worden gebruikt om energie op te slaan uit hernieuwbare maar intermitterende energiebronnen zoals zonne- en windenergie, die overtollige elektriciteit produceren wanneer de zon schijnt of wanneer de wind waait, maar die op regenachtige of rustige dagen inactief zijn.

Wanneer vergroot, de tweedimensionale metaalcarbiden lijken op platen cellphane. Krediet:foto van Xining Zang, copyright Wiley
Maar simpelweg een elektrode in een glas water steken is een uiterst inefficiënte methode om waterstofgas te genereren. De afgelopen 20 jaar, wetenschappers hebben gezocht naar katalysatoren die deze reactie kunnen versnellen, waardoor het praktisch is voor grootschalig gebruik.
"In de industrie domineert de traditionele manier om watergas te gebruiken om waterstof op te wekken. deze methode produceert koolstofdioxide als bijproduct, " zei eerste auteur Xining Zang, die het onderzoek deed als afstudeerstudent werktuigbouwkunde aan UC Berkeley. "De opwekking van elektrokatalytische waterstof neemt het afgelopen decennium toe, in navolging van de wereldwijde vraag om de uitstoot te verlagen. De ontwikkeling van een zeer efficiënte en goedkope katalysator voor elektrohydrolyse zal diepgaande technische, economisch en maatschappelijk voordeel."
Om de katalysator te creëren, de onderzoekers volgden een recept dat bijna net zo eenvoudig was als het maken van Jell-O uit een doos. Ze mengden gelatine en een metaalion - ofwel molybdeen, wolfraam of kobalt - met water, en laat het mengsel vervolgens drogen.
"Wij geloven dat als gelatine droogt, het assembleert zichzelf laag voor laag, Lin zei. "Het metaalion wordt gedragen door de gelatine, dus wanneer de gelatine zichzelf assembleert, je metaalion is ook gerangschikt in deze platte lagen, en deze vlakke platen geven Jell-O zijn karakteristieke spiegelachtige oppervlak."
Door het mengsel te verwarmen tot 600 graden Celsius, gaat het metaalion reageren met de koolstofatomen in de gelatine, grote vormen, nanometer-dunne platen van metaalcarbide. De niet-gereageerde gelatine brandt weg.
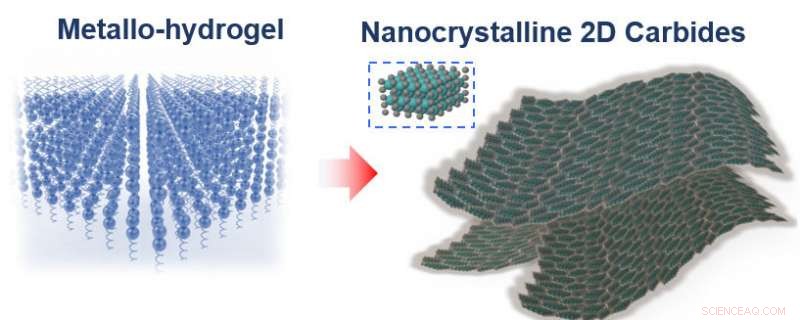
Moleculen in gelatine assembleren van nature zelf in platte vellen, met de metaalionen mee (links). Door het mengsel te verwarmen tot 600 graden Celsius verbrandt de gelatine, nanometer-dunne platen metaalcarbide achterlatend. Krediet:Xining Zang-illustratie, copyright Wiley
De onderzoekers testten de efficiëntie van de katalysatoren door ze in water te plaatsen en er een elektrische stroom doorheen te laten lopen. Wanneer ze tegen elkaar worden gestapeld, molybdeencarbide splitwater het meest efficiënt, gevolgd door wolfraamcarbide en vervolgens kobaltcarbide, die niet zo dunne lagen vormden als de andere twee. Het mengen van molybdeenionen met een kleine hoeveelheid kobalt verhoogde de prestaties nog meer.
"Het is mogelijk dat andere vormen van carbide nog betere prestaties leveren, ' zei Lin.
De tweedimensionale vorm van de katalysator is een van de redenen waarom deze zo succesvol is. Dat komt omdat het water in contact moet zijn met het oppervlak van de katalysator om zijn werk te kunnen doen, en het grote oppervlak van de platen betekent dat de metaalcarbiden uiterst efficiënt zijn voor hun gewicht.
Omdat het recept zo eenvoudig is, het kan gemakkelijk worden opgeschaald om grote hoeveelheden van de katalysator te produceren, zeggen de onderzoekers.
"We ontdekten dat de prestaties heel dicht in de buurt komen van de beste katalysator gemaakt van platina en koolstof, wat de gouden standaard is op dit gebied, Lin zei. "Dit betekent dat we het zeer dure platina kunnen vervangen door ons materiaal, die is gemaakt in een zeer schaalbaar productieproces."
 Nieuwe methode voor hydroborering van alkynen:Radicalen induceren ongebruikelijke selectiviteit
Nieuwe methode voor hydroborering van alkynen:Radicalen induceren ongebruikelijke selectiviteit Nieuwe ontdekking maakt snelladen mogelijk, beter presterende lithium-ionbatterijen mogelijk
Nieuwe ontdekking maakt snelladen mogelijk, beter presterende lithium-ionbatterijen mogelijk Tandpasta Science Projects
Tandpasta Science Projects Beoordeling van de overleving in de lucht van bacteriën in aerosoldruppels van hoesten en niezen
Beoordeling van de overleving in de lucht van bacteriën in aerosoldruppels van hoesten en niezen Nieuwe benadering voorspelt het altijd evoluerende gedrag van glas bij verschillende temperaturen
Nieuwe benadering voorspelt het altijd evoluerende gedrag van glas bij verschillende temperaturen
 Belangrijkste verschillen tussen C3, C4 en CAM Fotosynthese
Belangrijkste verschillen tussen C3, C4 en CAM Fotosynthese Klimaatverandering brengt de gezondheid in gevaar en economen hebben het juiste recept
Klimaatverandering brengt de gezondheid in gevaar en economen hebben het juiste recept Economen ontdekken dat de ecologische voetafdruk groeit met het ouderschap
Economen ontdekken dat de ecologische voetafdruk groeit met het ouderschap Klimaatverandering en recreatieve activiteiten bij Walden Pond hebben het ecosysteem veranderd
Klimaatverandering en recreatieve activiteiten bij Walden Pond hebben het ecosysteem veranderd Hoeveel vis eten we? Eerste wereldwijde voetafdruk van zeevruchtenconsumptie gepubliceerd
Hoeveel vis eten we? Eerste wereldwijde voetafdruk van zeevruchtenconsumptie gepubliceerd
Hoofdlijnen
- Rapport benadrukt kansen en risico's in verband met synthetische biologie en bio-engineering
- Waarin verschillen mensen van onze voorouders?
- Wat zijn de 10 Major Body Systems?
- Wat zijn de kenmerken van een homozygoot fenotype?
- Onderzoek onthult hoe cellen zich herbouwen na mitose
- Waarom mensen schreeuwen,
- Typen biologie-experimenten
- Uit welke elementen bestaat glucose?
- Wat zijn de verschillen van eenvoudig en gestratificeerd weefsel?
- Nieuwe techniek om de chemische samenstelling en structuur van monsters te karakteriseren

- Sugar lost op in water sneller dan zoutwetenschappelijke projecten

- Studie volgt innerlijke werking van de hersenen met nieuwe biosensor

- Ontwikkeling van betere fabricagetechnieken voor pH-responsieve microcapsules

- Kleurrijke oplossing voor een knelpunt in de chemische industrie

 Metaalzepen kritisch in snelheid van bederf van olieverfschilderijen
Metaalzepen kritisch in snelheid van bederf van olieverfschilderijen PPPL-fysici bouwen diagnose die de plasmasnelheid in realtime meet
PPPL-fysici bouwen diagnose die de plasmasnelheid in realtime meet Verbetering van de prestaties van een thermo-elektrisch materiaal door selectieve atomen gedeeltelijk te vervangen door kationen
Verbetering van de prestaties van een thermo-elektrisch materiaal door selectieve atomen gedeeltelijk te vervangen door kationen De vangst van waarschuwingslabels op nepnieuws
De vangst van waarschuwingslabels op nepnieuws On-demand controle van terahertz- en infraroodgolven
On-demand controle van terahertz- en infraroodgolven Zwarte gaten gedragen zich soms als conventionele kwantumsystemen
Zwarte gaten gedragen zich soms als conventionele kwantumsystemen Memo's:Facebook stond vriendelijke fraude toe om te profiteren van kinderen
Memo's:Facebook stond vriendelijke fraude toe om te profiteren van kinderen Beweegt de Melkweg als een tol?
Beweegt de Melkweg als een tol?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

