Wetenschap
Onderzoek onthult hoe een klein molecuul de verwijdering van overtollig cholesterol bevordert
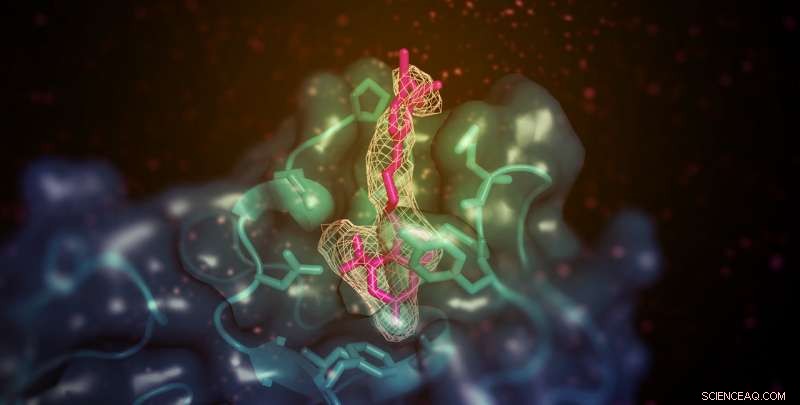
Een klein molecuul (hier in roze weergegeven) met het vermogen om 'goed' (HDL) cholesterol in diermodellen te verhogen, bindt aan het membraanbindende domein van lecithine:cholesterol acyltransferase (LCAT; weergegeven in groenblauw). De plaats is ver verwijderd van de actieve plaats van het enzym, maar maakt op de een of andere manier de overdracht van lipidesubstraten van HDL mogelijk. Krediet:Kelly Manthei en Stephanie King
Wetenschappers hebben de structuur bepaald van de geactiveerde vorm van een enzym dat helpt om overtollig cholesterol terug te brengen naar de lever, een studie in eLife rapporten.
Het onderzoek laat zien hoe een medicijnachtige chemische stof de werking van het lecithine:cholesterol acyltransferase (LCAT) enzym stimuleert. Het suggereert ook dat toekomstige geneesmiddelen die hetzelfde mechanisme gebruiken, kunnen worden gebruikt om de LCAT-functie te herstellen bij mensen met familiale LCAT-deficiëntie (FLD), een zeldzame erfelijke ziekte waardoor ze risico lopen op oogproblemen, bloedarmoede en nierfalen.
LCAT helpt lipoproteïne met hoge dichtheid (HDL) - bekend als het 'goede' cholesterol - om cholesterol uit het bloed te verwijderen door het lipide om te zetten in een vorm die gemakkelijker te verpakken en te vervoeren is. Er zijn meer dan 90 bekende mutaties in LCAT, die ofwel een gedeeltelijk verlies van activiteit (bekend als 'vissenoogziekte') of volledig verlies (FLD) kunnen veroorzaken. Het stimuleren van de LCAT-activiteit zou daarom gunstig kunnen zijn bij de behandeling van mensen met coronaire hartziekten en LCAT-tekorten, maar de mechanismen waarmee het kan worden geactiveerd, zijn slecht begrepen.
"In dit onderzoek, we hebben structurele biologie gebruikt om te begrijpen hoe een gepatenteerde LCAT-activator bindt aan LCAT en hoe het cholesteroltransport bevordert, " zegt hoofdauteur Kelly Manthei, een postdoctoraal onderzoeker aan het Life Sciences Institute van de Universiteit van Michigan, ONS. "We vroegen ook of de verbinding zou kunnen helpen bij het herstellen van de activiteit van LCAT-enzymen die vaak mutaties hebben waargenomen in FLD."
Het team gebruikte röntgenkristallografie om te kijken naar het LCAT-enzym dat in zijn actieve toestand is gestabiliseerd met twee verschillende chemicaliën:het activatormolecuul, en een tweede verbinding die een aan het enzym gebonden substraat nabootst. De twee chemicaliën hadden meer effect op het eiwit wanneer ze samen werden gepresenteerd dan wanneer ze afzonderlijk werden gepresenteerd, wat suggereerde dat ze op verschillende plaatsen aan het enzym binden.
Verdere analyse wees uit dat het activatormolecuul, in tegenstelling tot andere bekende LCAT-activators, bindt aan een gebied dichtbij waar HDL hecht. Echter, de activator hielp LCAT niet effectiever aan de HDL te binden, wat het team ertoe bracht te speculeren dat het in plaats daarvan helpt om cholesterol en lipiden over te brengen naar het katalytische centrum van het enzym, zodat het deze kan omzetten in vracht voor transport in HDL.
Nadat deze manier van handelen is vastgesteld, de onderzoekers testten of dit molecuul zou kunnen helpen de cholesteroltransportfunctie van een gemuteerd LCAT-enzym te herstellen. Ze maakten een versie van het enzym met een mutatie die vaak wordt gezien bij FLD-patiënten, en testte vervolgens zijn vermogen om te binden aan HDL en cholesterol om te zetten in de aanwezigheid of afwezigheid van het activatormolecuul. Ze waren enthousiast toen ze ontdekten dat de activator het verlies van activiteit in de gemuteerde enzymen gedeeltelijk kon omkeren, wat resulteert in een vergelijkbare cholesterolomzetting naar het normale enzym.
"Onze resultaten zullen wetenschappers helpen bij het ontwerpen van verbindingen die zich beter kunnen richten op LCAT, zodat ze van therapeutisch voordeel kunnen zijn voor hartaandoeningen en FLD-patiënten, " concludeert senior auteur John Tesmer, Walther Professor in de structurele biologie van kanker aan de Purdue University, ONS. "Toekomstige inspanningen zullen zijn om te onderzoeken of patiënten met andere LCAT-genetische mutaties kunnen profiteren van de verbindingen die in deze studie worden gebruikt, en om moleculen te ontwerpen met verbeterde farmacologische eigenschappen voor verdere ontwikkeling."
 Steam
Steam Neutronen onderzoeken moleculair gedrag van voorgestelde COVID-19 kandidaat-geneesmiddelen
Neutronen onderzoeken moleculair gedrag van voorgestelde COVID-19 kandidaat-geneesmiddelen Video:Waarom chemici marcheerden voor wetenschap
Video:Waarom chemici marcheerden voor wetenschap Onderzoekers identificeren breekpunt van geleidend materiaal
Onderzoekers identificeren breekpunt van geleidend materiaal Nieuwe techniek om de ductiliteit van keramische materialen voor raketten te verbeteren, motoren
Nieuwe techniek om de ductiliteit van keramische materialen voor raketten te verbeteren, motoren
Hoofdlijnen
- In populaties van microben, bio-ingenieurs vinden een balans tussen tegengestelde genomische krachten
- Zijn gelukkige mensen aardiger?
- Wat is het belang van nucleïnezuren?
- Wetenschappers ontdekken een eeuwenoud geval van identiteitsverwisseling in de Chesapeake Bay
- Wat zijn de vier organische moleculen die in levende wezens worden gevonden?
- Wereldwijd belang van honingbijen voor natuurlijke habitats vastgelegd in nieuw rapport
- Een flitsende gele keelzanger? Daar zijn genen voor
- Cryo-EM-beeldvorming suggereert hoe de dubbele helix scheidt tijdens replicatie
- Waarom we vleermuizen niet zo snel moeten demoniseren
 Natuurkundigen detecteren exotische lusvormige lichtbanen in een experiment met drie spleten
Natuurkundigen detecteren exotische lusvormige lichtbanen in een experiment met drie spleten Hoe de dichtheid van Ice
Hoe de dichtheid van Ice Een nieuwe wending in het verhaal van de donkere materie
Een nieuwe wending in het verhaal van de donkere materie Big data-analyse onthult onthutsende mate van genderongelijkheid in creatieve industrieën
Big data-analyse onthult onthutsende mate van genderongelijkheid in creatieve industrieën Borofeen op zilver groeit vrijelijk uit tot een atomaire huid
Borofeen op zilver groeit vrijelijk uit tot een atomaire huid Hoe bouw je een DNA-model uit tandenstokers
Hoe bouw je een DNA-model uit tandenstokers Hittegolf signaleert de groei van een stellair embryo
Hittegolf signaleert de groei van een stellair embryo Marsmaan Phobos in een ander licht bekijken
Marsmaan Phobos in een ander licht bekijken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com