
Wetenschap
De 3 meter hoge microscopen helpen de ergste ziekten ter wereld te bestrijden
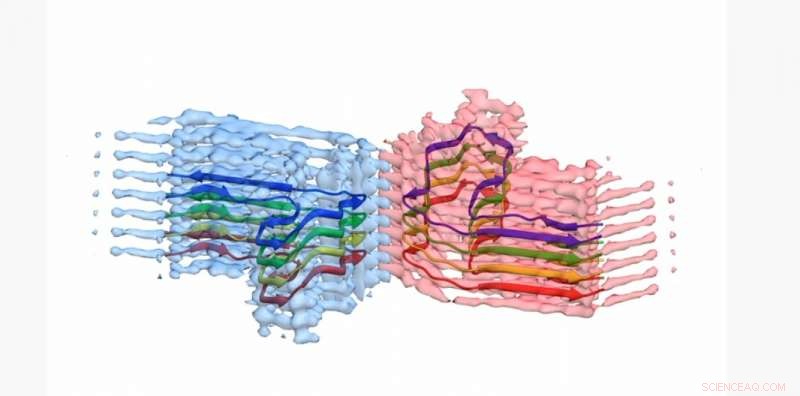
Een doorsnede van een b2m amyloïde fibril, met het atoommodel voor 8 kopieën van het b2m-eiwit ingebouwd in de EM-dichtheid. De fibril is opgebouwd uit twee 'protofilamenten' die om elkaar heen wikkelen (blauw en roze). Dit gedeelte is ongeveer 4 miljardste van een meter lang Credit:University of Leeds
De eeuwenoude missie om te begrijpen hoe de eiwitten die verantwoordelijk zijn voor op amyloïde gebaseerde ziekten zoals Alzheimer, Het werk van Huntingdon en Parkinson heeft de afgelopen 12 maanden grote stappen vooruit gezet, dankzij een revolutie in een krachtige microscopietechniek die door wetenschappers wordt gebruikt.
Krachtige microscopen die elektronen gebruiken in plaats van licht om de werkelijke vorm van monsters die eronder worden geplaatst te 'zien', op bijna atomaire detailniveaus, zijn pas sinds kort beschikbaar voor Britse wetenschappers.
Het VK heeft zwaar geïnvesteerd in de 'game-changing' cryo-elektronenmicroscopen, maar er zijn nog steeds minder dan 25 van de multi-miljoen pond instrumenten in Britse universiteiten en onderzoeksinstituten.
De twee instrumenten aan de Universiteit van Leeds, gefinancierd door de universiteit zelf en Wellcome, zijn de enige in hun soort in het noorden van Engeland.
Ze hebben hun waarde al bewezen als een belangrijk hulpmiddel voor wetenschappers die ze in een aantal onderzoeksprojecten hebben gebruikt, maar hebben zojuist hun grootste succes tot nu toe behaald:het onthullen van de structuur van amyloïde - een opeenhoping van abnormale eiwitten in het lichaam die ziekte veroorzaakt.
Er zijn minder dan 10 afbeeldingen en structuren van goede kwaliteit van dit soort eiwitten beschikbaar om in de wereld te bestuderen, dus het onderzoek van Leeds levert een belangrijke bijdrage aan het begrip van wetenschappers over hoe eiwitten aggregaten vormen en hoe ze kunnen bijdragen aan amyloïde ziekte.
De afbeeldingen en 3D-structuren van de eiwitaggregaten - waarvan de wetenschappers uit Leeds lieten zien dat ze lang, gedraaide vezels - is gepubliceerd in het tijdschrift Natuurcommunicatie . Het betrokken eiwit - β2-microglobuline - is normaal gesproken betrokken bij een gezond immuunsysteem, maar kan samenkomen in de pijnveroorzakende amyloïde vezels bij mensen die langdurige dialyse ondergaan voor nierfalen. Wanneer ze zich in de gewrichten van mensen nestelen, kunnen ze artrose veroorzaken
Verwacht wordt dat de bevindingen zullen worden gebruikt door geneesmiddelenfabrikanten en onderzoeksgroepen internationaal die ernaar streven om behandelingen voor alle soorten amyloïde ziekten te financieren.
Professor Sheena Radford FMedSci, FRS en professor Neil Ranson van het Astbury Centre for Structural Molecular Biology van de universiteit, leidde het vijfjarenprogramma om de eiwitvezels in beeld te brengen en hun 3D-structuur te tonen.
Het paar werd ondersteund door collega's in Leeds, Josh Bestuursman, die op dat moment een bachelorstudent biochemie was.

Dokter Rebecca Thompson, de Cryo-Electron Microscopy Center Manager van de University of Leeds laadt een monster in een van de microscopen. Krediet:Universiteit van Leeds
De studie omvatte ook een langdurige samenwerking met professor Bob Griffin, van het Massachusetts Institute for Technology, die gespecialiseerd is in een andere methode voor geavanceerde biologische analyse van biologische materie:kernmagnetische resonantie in vaste toestand.
Professor Radford zei:"In de afgelopen zes decennia sinds de eerste elektronenmicroscopiebeelden van amyloïde werden gemaakt, wetenschappers zijn geëvolueerd van het werken met wazige afbeeldingen met een lage resolutie naar onze haarscherpe 3D-beelden en structuren, dankzij moderne vooruitgang in cryo-elektronenmicroscopie.
"Nu weten we precies waar elke knik en punt op het eiwit zit, we kunnen misschien verbindingen ontwikkelen die er stevig aan vastzitten, of het verstoren, en ontdek hoe de vezels bijdragen aan ziekte. Het is hetzelfde als proberen om twee ballonnen aan elkaar te laten kleven naar twee tandwielen die perfect met elkaar draaien.
Ze voegde eraan toe:"We hebben cryo-elektronenmicroscopie niet alleen gebruikt om de vorm en structuur van amyloïde-eiwitten te ontdekken, maar ook hoe ze groeien en met elkaar verstrengeld raken als de stands in een touw om grotere assemblages te vormen. Deze kennis zal cruciaal zijn om te weten hoe ermee om te gaan."
Professor Ranson zei:"Tot een jaar of zo geleden, wetenschappers wisten dat de structuur min of meer op een ladder leek, maar we hebben nu laten zien dat het veel complexer is dan dat. We beginnen nu te zien hoe verschillende eiwitten zich in verschillende vormen opvouwen en hoe die variëren bij elke ziekte die ze veroorzaken.
"Het extra detail dat we hebben ontdekt, betekent dat we de ziekteverwekkende vermogens van deze eiwitten kunnen gaan begrijpen.
Hij voegde eraan toe:"Van amyloïde vezels is ook bekend dat ze de sterkte van staal hebben, en, nu begrijpen we hun structuren. Misschien kunnen we nieuwe biomaterialen maken, geïnspireerd door hun structuren. Dit is een goed voorbeeld van waar cryo-elektronenmicroscopie extra voordelen kan hebben."
Als we de structuur van het eiwit kennen in het detailniveau dat de Leeds-onderzoekers hebben verstrekt, en het meten van die verschillen in verschillende soorten amyloïde ziekte en verschillende patiënten, zou artsen ook in staat kunnen stellen om te laten zien wie het meeste risico loopt, wat betekent dat de behandeling kan worden gericht op degenen die het het meest nodig hebben.
De volgende stap voor de wetenschappelijke gemeenschap is om te beginnen met het identificeren en ontwikkelen van remmers - verbindingen die de eiwitassemblage tot amyloïde kunnen regelen. Professor Radford heeft bijna £ 2 miljoen van Wellcom binnengehaald om deze ontwikkelingsfase uit te voeren.
Verdere laboratoriumproeven, klinische proeven, goedkeuring van de regelgevende instanties en de betrokkenheid van een geneesmiddelontwikkelaar nog steeds vereist zijn voordat geneesmiddelen op de markt kunnen worden gebracht, maar de belangrijke stappen voorwaarts in beeldhelderheid en begrip van de amyloïde vouwstructuur markeren een grote sprong voorwaarts.
Het volledige onderzoeksartikel De structuur van een β2microglobuline-fibrillen suggereert een moleculaire basis voor zijn amyloïde polymorfisme is gepubliceerd in Natuurcommunicatie .
 Onderscheidende MJO-activiteit tijdens 2015/2016 super El Nino
Onderscheidende MJO-activiteit tijdens 2015/2016 super El Nino Inwoners van Paaseiland verzamelden zoet water aan de rand van de oceaan om te overleven
Inwoners van Paaseiland verzamelden zoet water aan de rand van de oceaan om te overleven Hoeveel uitstoot van broeikasgassen komt door tropische ontbossing en verlies van veengebieden?
Hoeveel uitstoot van broeikasgassen komt door tropische ontbossing en verlies van veengebieden? Hoe het coronavirus de luchtkwaliteit heeft veranderd en wat het kan betekenen voor het weer
Hoe het coronavirus de luchtkwaliteit heeft veranderd en wat het kan betekenen voor het weer Verborgen diepten - waarom grondwater onze belangrijkste waterbron is
Verborgen diepten - waarom grondwater onze belangrijkste waterbron is
Hoofdlijnen
- Scheepslawaai beïnvloedt het vermogen van mariene soorten om te communiceren
- Hoe Facebook kraakt over nepnieuws (en waarom nepnieuws werkt)
- Nieuwe studie verifieert meer manieren om te overleven voor bedreigde Chinook-zalm in de winter
- Licht schijnen op het sociale leven van virussen
- Genetische ontdekking nog een hulpmiddel in de strijd tegen tarweplagen
- Genomisch onderzoek onthult aanwijzingen voor het wilde verleden van druiven
- Hoe een zevende-graadsmodel van een dierencel te bouwen
- milities, stropers richten grote schade aan in het wild in Centraal-Afrika:monitor
- Hoe de griezelige verkenningen van de zomer
- Succesvolle synthese van nanomateriaal dat de efficiëntie van de katalysator verbetert

- Chemici bereiken belangrijke mijlpaal van synthese:chirale inductie op afstand
- Sterke velden en ultrasnelle bewegingen - hoe elektronen in vloeibaar water te genereren en te sturen?
- Vormverschuivende protocellen duiden op de mechanica van het vroege leven

- Informatiefilter voor immuunafweer
 Koppelingen en uiteenvallen van autofabrikanten
Koppelingen en uiteenvallen van autofabrikanten Onderzoekers leggen in realtime rondzwervende moleculaire fragmenten vast
Onderzoekers leggen in realtime rondzwervende moleculaire fragmenten vast Mobiele telefoons gebruiken als windwijzers in de ruimte
Mobiele telefoons gebruiken als windwijzers in de ruimte Nieuw effectief en veilig antischimmelmiddel geïsoleerd uit het microbioom van de waterpijp
Nieuw effectief en veilig antischimmelmiddel geïsoleerd uit het microbioom van de waterpijp Duitsland heeft tegen 2022 1 miljoen elektrische auto's
Duitsland heeft tegen 2022 1 miljoen elektrische auto's Elektriciteit maken uit zout water
Elektriciteit maken uit zout water  Risico op extreme weersomstandigheden groter als de doelstellingen van de Overeenkomst van Parijs niet worden gehaald
Risico op extreme weersomstandigheden groter als de doelstellingen van de Overeenkomst van Parijs niet worden gehaald Tientallen potentieel blootgesteld aan giftig kwik bij lekkage Houston
Tientallen potentieel blootgesteld aan giftig kwik bij lekkage Houston
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

