Wetenschap
Wetenschappers lossen 3D-structuur van cystic fibrosis-eiwit op in actieve, inactieve staten
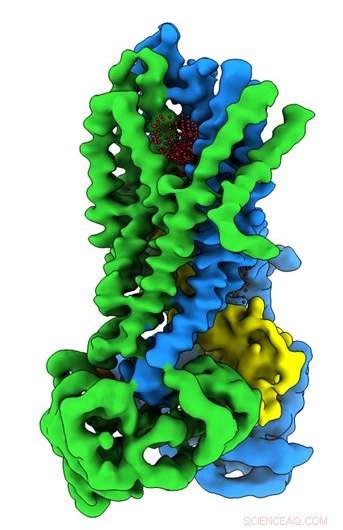
Krediet:Universiteit van North Carolina aan de Chapel Hill School of Medicine
Wetenschappers van de UNC School of Medicine hebben in samenwerking met onderzoekers van de Oregon Health &Science University de driedimensionale moleculaire structuur van het eiwit opgelost dat defect is bij mensen met cystische fibrose in de actieve en inactieve toestand van het eiwit. De vondst, gepubliceerd in het tijdschrift Biochemie , zou nieuwe onderzoeksmogelijkheden kunnen openen en medicijnontwikkelaars kunnen helpen verbeterde farmacotherapieën te creëren om mensen met CF te helpen.
Veel van het biochemische werk werd gedaan in het lab van John Riordan, doctoraat, onderscheiden hoogleraar biochemie en biofysica aan de UNC-Chapel Hill. Eind jaren tachtig, Het laboratorium van Riordan ontdekte het gemuteerde gen dat verantwoordelijk is voor CF. Als een kind van elke ouder een kopie van dit defecte gen krijgt, het kind zal CF ontwikkelen. Het eiwit dat door dit gen wordt gecodeerd, werd de transmembraanregulator van cystische fibrose genoemd, of CFTR, dat is het chloridekanaal in epitheelcellen die het ademhalingssysteem bevolken. Mensen met CF missen een functioneel epitheliaal chloridekanaal, wat essentieel is voor het handhaven van de juiste balans van zout en water in de longen en andere organen. Een resultaat hiervan is de productie van dikke, kleverig slijm dat moeilijk uit de luchtwegen komt, leidend tot chronische infecties en een kortere levensduur voor de meeste mensen met CF.
In het Riordan-lab, postdoctoraal fellow Jonathan Fay, doctoraat, leidde experimenten met behulp van cryo-elektronenmicroscopie met enkelvoudige deeltjes om de moleculaire structuur van CFTR te ontdekken in de aanwezigheid van ATP - een complexe organische chemische stof die nodig is voor veel processen in cellen, inclusief een werkend chloride-ionkanaal dat cruciaal is voor een goede longfunctie. Om structuren van het CFTR-eiwit in zijn actieve en inactieve toestand te helpen vangen, het Riordan-lab stabiliseerde het CFTR-eiwit zodanig dat het kanaal uitgeschakeld was wanneer het werd gedefosforyleerd en vergrendeld wanneer het werd gefosforyleerd.
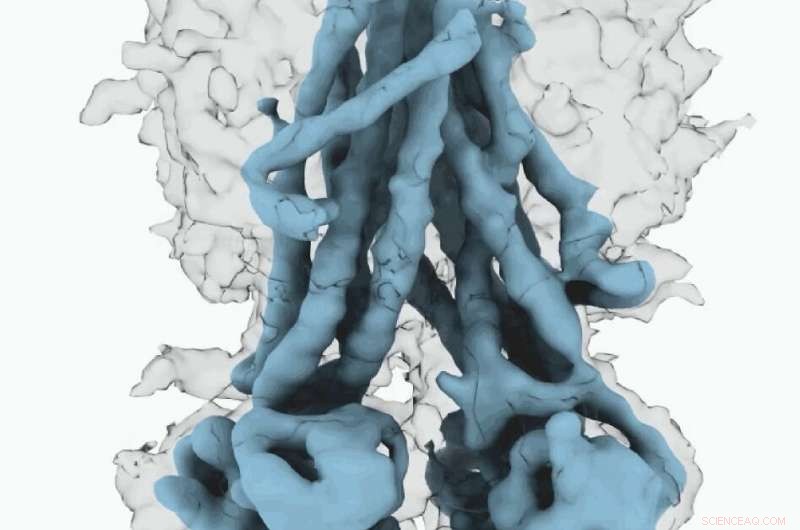
Cryo-EM-kaart van CFTR. Krediet:Universiteit van North Carolina aan de Chapel Hill School of Medicine
Deze moleculaire structuren onthullen een unieke herpositionering van delen van het CFTR-eiwit, het verschaffen van inzicht in de structurele overgang tussen actieve en inactieve functionele toestanden van CFTR.
Bovendien, Fay en collega's observeerden details van dit eiwitcomplex die verschillen van wat andere wetenschappers hebben ontdekt in eerdere CFTR-structuren.
"Het is echt verbazingwekkend hoeveel cryo-EM-technologieën zijn gevorderd en hoe het gebruik van deze technieken ons in staat kan stellen verschillende toestanden van het kanaal te visualiseren, " zei Fay. "Ik denk dat onze resultaten erg spannend zijn. We hebben een nieuwe portal ontdekt die een veelbelovend nieuw gebied van het kanaal presenteert om de CFTR-kanaalfunctie te targeten en te controleren."
En als onderzoekers de functie van dat kanaal met succes kunnen richten en controleren, dan zouden ze preciezere therapieën kunnen creëren om sommige mensen met CF beter te behandelen.
Hoofdlijnen
- Hoe werkt het skelet met het ademhalingssysteem?
- Neteldieren controleren bacteriën op afstand
- Schimmelmicroben als biomeststoffen in landbouw en tuinieren:is de beloning groter dan het risico?
- Waarom zingen mensen onder de douche?
- Wat is een organel in een cel?
- Definitie van menselijke biologie
- Geven dieren bewustzijn aan?
- De straal van de aarde vinden
- Verander je geliefde in een boom met Bios Urn
 Journalisten kunnen vooringenomen opvattingen voorkomen door feiten te beoordelen, experiment laat zien
Journalisten kunnen vooringenomen opvattingen voorkomen door feiten te beoordelen, experiment laat zien Kenmerken van de zes rijken van organismen
Kenmerken van de zes rijken van organismen  Bodemsoorten in Florida
Bodemsoorten in Florida Stijgende religieuze geen-tarieven gekoppeld aan conservatieve christelijke politiek
Stijgende religieuze geen-tarieven gekoppeld aan conservatieve christelijke politiek NASA's eerste weerbericht van Jezero Crater op Mars
NASA's eerste weerbericht van Jezero Crater op Mars Rovers bouwen die leven kunnen detecteren en DNA op andere werelden kunnen rangschikken
Rovers bouwen die leven kunnen detecteren en DNA op andere werelden kunnen rangschikken Waarom het bijwonen van een klimaatstaking van gedachten kan veranderen (vooral die van jezelf)
Waarom het bijwonen van een klimaatstaking van gedachten kan veranderen (vooral die van jezelf) Feiten over Eels for Kids
Feiten over Eels for Kids
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com