
Wetenschap
Cellulaire schoonmaakploegen gekoppeld aan hoe het lichaam met suiker omgaat

Asst. Prof. Raymond Moellering (rechts) met afgestudeerde studenten John Coukos (links) en Gihoon Lee (midden). Krediet:Irene Hsiao
Hoe ons lichaam omgaat met glucose - de eenvoudige suiker die energie levert uit het voedsel dat we eten - lijkt verweven te zijn met hoe cellen zichzelf normaal laten functioneren, volgens nieuw onderzoek van de Universiteit van Chicago.
De studie, gepubliceerd met wetenschappers van het Scripps Research Institute op 15 oktober in Natuur , vond een verband tussen het proces dat glucose in cellen verwerkt en het proces dat de ontgifting reguleert. Dit suggereert een nieuw begrip van een fundamentele functie in ons lichaam, en een die nieuwe inzichten kan bieden in aandoeningen van kanker tot diabetes.
Raymond Moellering, assistent-professor bij de afdeling Chemie van UChicago, probeerde de rol te ontrafelen van een bepaald molecuul dat betrokken is bij het pad dat het ontgiftingsproces van een cel in gang zet - een soort schoonmaakploeg om gifstoffen en ophopingen te verwijderen als er iets misgaat in de cel. Dit pad duikt op als je allerlei kwalen bestudeert:kanker, suikerziekte, ontstekingsziekten en neurodegeneratieve aandoeningen zoals de ziekte van Alzheimer.
Het bleek dat het belangrijkste eiwit om deze route op gang te brengen, KEAP1, werd geactiveerd door een nieuw klein molecuul dat in het laboratorium was ontdekt, maar het leek geen van de normale mechanismen te gebruiken die wetenschappers kennen.
Door de paden op te sporen die door dit molecuul worden beïnvloed, Het team van Moellering ontdekte dat het naast ontgifting nog een andere route betrof:de route die het lichaam gebruikt om glucose te verwerken. "Niemand wist dat die direct met elkaar verbonden waren, ', zegt Moellering.
Hoe ons lichaam omgaat met glucose, die wordt geproduceerd wanneer we voedsel afbreken voor energie, is cruciaal voor vrijwel al het leven over de hele wereld - en dus belangrijk bij veel ziekten, zoals suikerziekte. Omdat het zo oud en fundamenteel is, het is ook een heel moeilijk pad om in het laboratorium te manipuleren. "In tegenstelling tot veel genen of paden in menselijke cellen, je kunt niet zomaar processen uitschakelen die betrokken zijn bij het glucosemetabolisme om te zien hoe het verbinding maakt met andere routes, want als je dat doet, sterft de cel en gaan de verbindingen verloren, ', zegt Moellering.
Gelukkig, moeilijke biologische problemen zijn de specialiteit van Moellering. In de meeste technieken voor het bestuderen van biologie, wetenschappers kunnen slechts een glimp opvangen van momentopnamen van celactiviteit, zoals proberen de plot van The Matrix te begrijpen op basis van een paar frames uit de hele film. Het lab van Moellering probeert dat te verhelpen door technologie te ontwikkelen om activiteit en interacties in levende cellen te meten terwijl het gebeurt.
Door een combinatie van technieken te gebruiken, ze ontdekten dat KEAP1 daadwerkelijk tot actie wordt aangezet door een opeenhoping van glucose in de cel. "Het lijkt heel duidelijk alsof KEAP1 luistert naar het glucosemetabolisme, en daardoor ontgiftingsmechanismen aanzetten, ', zegt Moellering.
Het vreemde was hoe dit gebeurt. Onderzoekers toonden aan dat wanneer KEAP1 wordt blootgesteld aan een molecuul dat wordt geproduceerd tijdens de afbraak van glucose, individuele KEAP1-eiwitten komen in paren samen, die vervolgens een waterval van andere signalen in de cel triggert om ontgiftingsmechanismen te starten. Eerdere methoden konden niet detecteren hoe deze moleculen, eiwitten en routes waren interactie binnen de cel.
Nieuwe wegen openen
De ontdekking is opwindend op verschillende niveaus, aldus Moellering. Dit specifieke pad is een aanwijzing voor het begrijpen van allerlei soorten aandoeningen, omdat ontgifting zo'n belangrijke rol speelt in de cel. Er is ook veel dat onderzoekers niet weten over glucose, zoals hoe veranderingen in het glucosemetabolisme precies bijdragen aan complicaties bij ziekten, zoals zenuwbeschadiging die gepaard gaat met diabetes.
Aanvullend, het werk toont aan dat de cel zichzelf beschermt tegen schade door ontgifting op gang te brengen via het glucosemetabolisme, maar dit signaal te ver doordrukken - zoals kan gebeuren bij ziekten zoals diabetes - kan leiden tot schade die de capaciteit van de opruimploeg te boven gaat. "Voor veel ziekten waarbij het glucosemetabolisme betrokken is, het is intrigerend om nu te vragen of dit pad erbij betrokken is, ', zegt Moellering.
Op een ander niveau, deze ontdekking lijkt een nieuwe categorie vast te stellen van hoe eiwitten in het lichaam worden gecontroleerd. In hun zoektocht om te begrijpen wat er elke dag in menselijke cellen gebeurt, wetenschappers kennen twee belangrijke manieren waarop eiwitten hun werk kunnen doen. Eén manier is dat enzymen chemische markeringen op eiwitten plaatsen, ze uit en aan te zetten. De andere manier is dat vrij zwevende moleculen in de cel omkeerbaar interageren met eiwitten om hun functies te regelen. Deze studie lijkt een derde manier te vinden, wat een hybride is van de twee - waarbij deze vrij zwevende moleculen direct chemische markeringen vormen op de eiwitten waarmee ze een wisselwerking hebben, specifieke en langer durende effecten veroorzaken. "Het vinden van dit soort regulering met KEAP1 suggereert dat het een wijdverbreide manier is om de eiwitfunctie te controleren, ', zegt Moellering.
De ontdekking suggereert nieuwe therapeutische mogelijkheden. Farmaceutische bedrijven zijn erg geïnteresseerd in het activeren en deactiveren van KEAP1, omdat het de sleutel is tot zoveel aandoeningen. Eerdere pogingen gericht op het richten op KEAP1 zelf zijn in klinische onderzoeken op uitdagingen gestuit; dit nieuwe begrip van hoe het metabolisme in de route integreert, kan een nieuw mechanisme suggereren om hetzelfde effect te bereiken, aldus Moellering.
 Nieuwe functionele biochar-composieten helpen afvalwater te behandelen
Nieuwe functionele biochar-composieten helpen afvalwater te behandelen Een nieuwe strategie voor de optimale elektroreductie van CO2 tot hoogwaardige producten
Een nieuwe strategie voor de optimale elektroreductie van CO2 tot hoogwaardige producten Nieuw elektronisch apparaat detecteert explosieve dampen
Nieuw elektronisch apparaat detecteert explosieve dampen Ontworpen moleculen verwijderen selectief ongewenste ionen uit complexe oplossingen voor energieproductie
Ontworpen moleculen verwijderen selectief ongewenste ionen uit complexe oplossingen voor energieproductie Water beïnvloedt de plakkerigheid van hyaluronan
Water beïnvloedt de plakkerigheid van hyaluronan
 NASA's GPM ziet tropische storm Hector zich vormen
NASA's GPM ziet tropische storm Hector zich vormen NASA ziet tropische storm Flossie op weg naar de centrale Stille Oceaan
NASA ziet tropische storm Flossie op weg naar de centrale Stille Oceaan Planten die Amylase bevatten
Planten die Amylase bevatten  Kleding, meubels ook verantwoordelijk voor oceaan- en zoetwatervervuiling
Kleding, meubels ook verantwoordelijk voor oceaan- en zoetwatervervuiling Rook van bosbranden in New England is behoorlijk ernstig vanuit het perspectief van de volksgezondheid
Rook van bosbranden in New England is behoorlijk ernstig vanuit het perspectief van de volksgezondheid
Hoofdlijnen
- Enzymen die biobrandstoffen waard zijn, blijkt uit recent onderzoek
- Duurzaamheid van visserij gekoppeld aan genderrollen onder handelaren
- Hoe het Jeruzalem-syndroom werkt
- Lijst van aseksueel reproducerende organismen
- Wat zijn de rollen van chlorofyl A & B?
- Hoe voeden bacteriën?
- Hoe CFU uit verdunning te berekenen
- Hoe zijn fytoplankton reproductie?
- De voordelen van het gebruik van Sticky End Enzymen
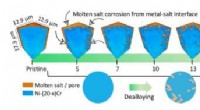
- Onderzoekers zien hoe gesmolten zouten in 3D kleine hoekjes en tunnels in metaallegeringen snijden
- Nieuw antibioticum vernoemd naar Leiden

- Een nieuwe katalysator met één atoom kan in uitzonderlijke snelheid waterstof produceren uit ureum

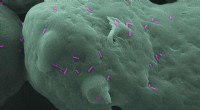
- Wetenschappers maken 3D-geprinte onderdelen die bacteriën kunnen doden
- Even kijken hoe ijsvorming voorruiten kan houden, hoogspanningsleidingen ijsvrij

 Biotische factoren in een overstroomd ecosysteem
Biotische factoren in een overstroomd ecosysteem  kloven,
kloven,  Menselijke migratie uit Afrika is mogelijk gevolgd door moessons in het Midden-Oosten
Menselijke migratie uit Afrika is mogelijk gevolgd door moessons in het Midden-Oosten The Big One was geen partij voor Alaskanen
The Big One was geen partij voor Alaskanen  Wetenschappers brengen een revolutie teweeg in cyberbeveiliging door middel van kwantumonderzoek
Wetenschappers brengen een revolutie teweeg in cyberbeveiliging door middel van kwantumonderzoek De ellende van Merkel neemt toe als minister van Landbouw orders negeert (update)
De ellende van Merkel neemt toe als minister van Landbouw orders negeert (update) Wat zijn twee soorten elektrische circuits?
Wat zijn twee soorten elektrische circuits?  Wat is het hoogste gebouw ter wereld?
Wat is het hoogste gebouw ter wereld?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

