
Wetenschap
De spanning van een cel meten met een molecuul
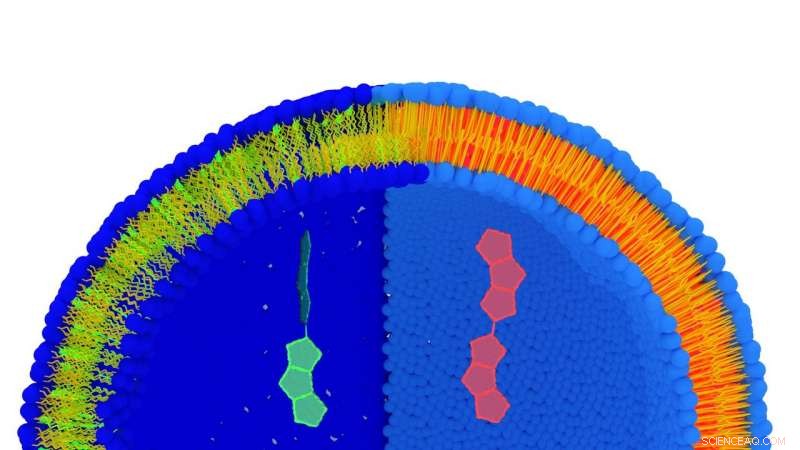
Artist's view van een lipidemembraan gemarkeerd met het FliptR-molecuul. De lipiden zijn blauw (hydrofiel deel) en geel (hydrofoob deel). Wanneer lipiden worden uitgerekt (linkerdeel) heeft het molecuul een korte levensduur (groen), terwijl wanneer lipiden compacter zijn, de levensduur is lang (rood). Beide conformaties worden op grote schaal in het midden van de afbeelding getoond. Krediet:© UNIGE
Het volume van cellen kan sterk variëren. Net als bij het opblazen van een ballon, de volumetoename van groeiende cellen drukt op het plasmamembraan - de lipide-envelop die de cel omringt. Deze "turgor" -druk verhoogt de spanning van het membraan, die, indien niet gecorrigeerd, zal uiteindelijk de cel doen barsten. Om dit te voorkomen, cellen hebben mechanismen ontwikkeld om de spanning van hun plasmamembraan te controleren. Als de spanning te hoog is, cellen reageren door de hoeveelheid lipide in het membraan te verhogen. Omgekeerd, wanneer de spanning te laag is, cellen verwijderen lipiden van het membraan om het "aan te spannen". Hoe cellen erin slagen om spanning te voelen en de juiste biologische reactie teweeg te brengen, is een mysterie gebleven. Het was moeilijk op te lossen vanwege een gebrek aan hulpmiddelen om de membraanspanning in levende cellen te bestuderen. Om dit probleem aan te pakken, onderzoekers van de Universiteit van Genève (UNIGE) en het National Center for Competence in Research Chemical Biology (NCCR) hebben samengewerkt om een fluorescerend molecuul te maken om de spanning van het plasmamembraan van levende cellen te meten. Met behulp van deze nieuwe tool, vervolgens konden ze ontdekken hoe cellen hun oppervlak aanpassen aan hun volume. deze resultaten, gepubliceerd in Natuurchemie en Natuur celbiologie , de weg vrijmaken voor vele toepassingen, inclusief bij de detectie van kankercellen die typisch een afwijkend hoge membraanspanning vertonen.
Als het volume van een cel toeneemt, de spanning op het membraan neemt toe, waardoor TORC2 wordt geactiveerd - een complex van eiwitten dat waarschuwingssignalen in de cel creëert. "Het celmembraan bestaat uit lipiden georganiseerd in een semi-permeabele dubbellaag, " legt Aurélien Roux uit, professor in de afdeling Biochemie van de Faculteit Wetenschappen van UNIGE en lid van de NCCR. "Dit oppervlak is vloeibaar, waardoor een groot aanpassingsvermogen van het membraan aan veranderingen in de vorm en het volume van de cel mogelijk is. Zoals elk oppervlak, het kan worden uitgerekt en de ruimte tussen lipiden neemt dan toe. Wanneer deze ruimte te groot wordt en het membraan dreigt te breken, een eiwit, genaamd Slm1, activeert TORC2 om signalen te produceren die de cel ertoe aanzetten nieuwe lipiden te produceren en op hun beurt de spanning van het celmembraan verminderen." Maar hoe konden de onderzoekers de spanning meten die nodig is om dit proces te activeren?
Om de spanning van het celmembraan te evalueren, het is noodzakelijk om de ruimte te kunnen meten tussen de lipiden die dit membraan vormen. Stefan Matile, professor in de afdeling Organische Chemie van de Faculteit Wetenschappen van UNIGE en lid van de NCCR, heeft een "probe-molecuul" gemaakt genaamd FliptR (Fluorescent Lipid Tension Reporter), die spontaan integreert tussen de lipiden van het plasmamembraan. "We hebben een fluorescerend molecuul ontwikkeld met twee kleine "vinnen" die een bepaalde hoek ertussen definiëren, hij legt uit. Deze hoek varieert afhankelijk van de druk die op FliptR wordt uitgeoefend, die zijn fluorescentie verandert." Door gebruik te maken van dit verschil in de fluorescentie-eigenschappen van het molecuul, de groep van professor Roux kon de ruimte tussen de lipiden en daarmee de spanning van een membraan meten.
FliptR is een waardevol nieuw hulpmiddel voor het meten van de spanning van het plasmamembraan in levende cellen. "We weten dat kankercellen een hogere membraanspanning hebben dan normale cellen. We hopen dat dit fluorescerende molecuul op een dag zal helpen om ze gemakkelijker te detecteren, ' zegt Stefan Matile.
En als het gaat om het verminderen van de spanning van de cel?
Wanneer de spanning van het plasmamembraan toeneemt, TORC2 wordt geactiveerd en dit triggert de productie van lipiden om de spanning terug te brengen naar basale waarden. Maar wat gebeurt er als de spanning van het membraan te laag is en verhoogd moet worden? "We dachten aanvankelijk dat het gebeurde via hetzelfde mechanisme dat in omgekeerde richting liep, maar het verhaal bleek veel interessanter, " zegt Robbie Loewith, professor in de afdeling Moleculaire Biologie van de UNIGE Faculteit Wetenschappen en tevens lid van de NCCR. Inderdaad, eerste onderzoek toonde aan dat de TORC2-activator Slm1 - betrokken bij het detecteren van hoge membraanspanning - verrassend genoeg geen rol speelt in de reactie op te weinig spanning. "Anderzijds, we hebben waargenomen dat een bepaald lipide dat aanwezig is in het plasmamembraan, genaamd PIP2, is de sensor voor lage membraanspanning."
Wanneer de membraanspanning afneemt, PIP2, eerder gemengd met andere lipiden, scheidt zichzelf af om PIP2 "eilanden" te vormen in een zee van resterende lipiden in het membraan, in een proces dat lijkt op het spontaan scheiden (rijzen) van room in verse melk. Omdat een van de eiwitten van TORC2 PIP2 bindt, TORC2 herverdeelt ook naar deze PIP2-eilandjes. Eenmaal overspoeld door deze eilandjes, TORC2 wordt gedeactiveerd. "De lipiden van het celmembraan worden van nature afgebroken, en TORC2-activiteit is nodig om ze te vervangen", legt Robbie Loewith uit. Maar wanneer TORC2 wordt geremd binnen de PIP2-eilandjes, de afgebroken lipiden worden niet meer vervangen, waardoor de spanning van het plasmamembraan toeneemt. Als dit herkalibratieproces wordt geblokkeerd, cellen kunnen de spanning van hun plasmamembraan niet aanpassen en sterven.
Een chemisch meetinstrument om onderzoek in de biologie te helpen
Dankzij de spanningsmeettechniek ontwikkeld door Stefan Matile en Aurélien Roux, de teams van professoren Roux en Loewith konden hun experimenten uitvoeren op gisten en de spanningsvariaties van het plasmamembraan meten. Membraanspanning is een zeer belangrijke parameter om te controleren in alle cellulaire processen waarbij membranen betrokken zijn, zoals beweeglijkheid, endocytose (het proces waardoor de cel zichzelf voedt), of celdeling, en vooral in het geval van kankerontwikkeling. De wetenschappers concentreren zich nu op het controleren of het mechanisme dat wordt waargenomen in gist hetzelfde is in menselijke cellen, met het langetermijnidee om geneesmiddelen te ontwikkelen die TORC2 kunnen reguleren, of zelfs om de ontwikkeling van bepaalde kankers te voorkomen.
Hoofdlijnen
- De connectiviteit van tijgers in stand houden en uitsterven tot een minimum beperken in de volgende eeuw
- Wat is vergelijkende biochemie?
- Hoe gigantische tropische fruitvleermuizen te redden:werk samen met lokale jagers die vleermuistanden als geld gebruiken
- Onderzoekers ontdekken dat twee verschillende ecologische mechanismen veerkracht kunnen bieden tegen invasieve soorten
- Wat zijn de drie belangrijkste verschillen tussen een plantencel en een dierencel?
- Hoe werkt het spierstelsel met de bloedsomloop?
- Voors en tegens van Cloning Plants & Animals
- 3 fasen van interfase
- Kaarten uit de Eerste Wereldoorlog helpen de geschiedenis van kelpbossen in Pacific Northwest te volgen
- Matras ontvlambaarheid standaard is een redder in nood, NIST rapport vondsten

- Onderzoekers bouwen eerste inzetbare, wandelen, zachte robot

- Thermische oorkappen beschermen de batterijen van mobiele telefoons tegen extreme temperaturen
- Elektrodepositie en gloeien gebruikt om de hardheid in nanokorrelige metalen aan te passen

- Ingenieurs maken een eenvoudige test die stresshormonen in zweet kan meten, bloed, urine of speeksel

 Studie van boomringen biedt meer bewijs van poolwaartse migratie van tropische stormen
Studie van boomringen biedt meer bewijs van poolwaartse migratie van tropische stormen Gemini South-telescoop legt prachtige planetaire nevel vast
Gemini South-telescoop legt prachtige planetaire nevel vast Dieren die zijn gevonden in een tropisch regenwoud
Dieren die zijn gevonden in een tropisch regenwoud  Middeleeuwse inkten voor erfgoedconservering
Middeleeuwse inkten voor erfgoedconservering De CO2-belasting die huishoudens beter af zou maken
De CO2-belasting die huishoudens beter af zou maken Nieuwe methode om impact zeespiegelstijging te detecteren
Nieuwe methode om impact zeespiegelstijging te detecteren Heeft een schurkenster de samenstelling van ons zonnestelsel veranderd?
Heeft een schurkenster de samenstelling van ons zonnestelsel veranderd? Virtual reality-bossen kunnen helpen bij het begrijpen van klimaatverandering
Virtual reality-bossen kunnen helpen bij het begrijpen van klimaatverandering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


