
Wetenschap
Nieuw ontworpen molecuul bindt stikstof

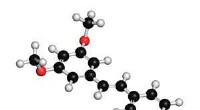
Een stikstofmolecuul (blauw) is verbonden met twee boryleenmoleculen (grijs). De bij de binding betrokken booratomen zijn in de afbeelding groen gekleurd. Krediet:Dr. Rian Dewhurst, JMU
Tarwe, gierst en maïs hebben allemaal stikstof nodig om te groeien. Meststoffen bevatten daarom grote hoeveelheden stikstofverbindingen, die gewoonlijk worden gesynthetiseerd door stikstof om te zetten in ammoniak in het industriële Haber-Bosch-proces, vernoemd naar zijn uitvinders. Deze technologie wordt gecrediteerd met het voeden van tot de helft van de huidige wereldbevolking.
Lucht bestaat voor bijna 80 procent uit stikstof (N2), wat echter, extreem onreactief, omdat de binding tussen de twee stikstofatomen erg stabiel is. Het Haber-Bosch-proces verbreekt deze band, stikstof omzetten in ammoniak (NH3) dat door planten kan worden opgenomen en gebruikt. Deze stap vereist zeer hoge drukken en temperaturen en is zo energie-intensief dat naar schatting 1 procent van de wereldwijd opgewekte primaire energie wordt verbruikt.
"Dus zochten we een manier om stikstof te splitsen die energetisch gunstiger is, " legt professor Holger Braunschweig van het Instituut voor Anorganische Chemie van de Julius-Maximilians-Universität Würzburg (JMU) in Beieren uit, Duitsland. Bepaalde bacteriën laten zien dat dit echt werkt:ze kunnen dit bij normale druk en temperatuur door gebruik te maken van het stikstofase-enzym dat de reactie katalyseert met behulp van de overgangsmetalen ijzer en molybdeen.
"We zijn er tot nu toe niet in geslaagd een soort stikstofase te reproduceren, "zegt Braunschweig. "Dus zijn we op zoek gegaan naar een alternatief:een molecuul dat de reactie kan katalyseren en niet is gebaseerd op overgangsmetalen."
Zijn team heeft specifieke boorbevattende verbindingen bestudeerd, de zogenaamde borylenen, voor jaren. Ze worden beschouwd als potentiële kandidaten voor een dergelijke katalysator. Maar hoe moet het overeenkomstige boryleenmolecuul daarvoor precies worden gestructureerd?
Het is bekend dat het ijzer en molybdeen in het stikstofase elektronen afstaan aan het stikstofmolecuul, een proces dat reductie wordt genoemd. Hierdoor wordt de binding tussen de twee N-atomen verbroken. Echter, dit werkt alleen omdat de overgangsmetalen goed passen bij het stikstofmolecuul:hun orbitalen, de ruimte waar de elektronen tijdens de reductie zijn gepasseerd, door hun ruimtelijke indeling aanzienlijk overlappen met die van de stikstof.
Op basis van kwantummechanische voorspellingen, Dr. Marc-André Légaré van het Instituut voor Anorganische Chemie ontwierp een boryleen met een vergelijkbare orbitale opstelling. De resultaten van zijn onderzoek werden vervolgens synthetisch getest in het JMU-instituut.
En met succes, omdat het op deze manier geproduceerde boryleen stikstof kon binden - en dat bij kamertemperatuur en normale luchtdruk. "Voor de eerste keer, we konden aantonen dat niet-metalen verbindingen ook in staat zijn om deze stap te volbrengen, ’ benadrukt Légaré.
Echter, dit betekent niet dat het Haber-Bosch-proces op het punt staat te worden afgeschaft. Voor een ding, het is niet zeker dat de gereduceerde stikstof van het boryleen kan worden losgemaakt zonder het te vernietigen. Echter, deze stap is nodig om de katalysator te recyclen zodat deze beschikbaar is om zich vervolgens aan het volgende stikstofmolecuul te binden.
"Of dit uiteindelijk een energetisch gunstiger methode zal opleveren, is nog een open vraag, " zegt professor Braunschweig. "Het is pas de allereerste stap, zij het een belangrijke, op weg naar het bereiken van het uiteindelijke doel."
De resultaten van de studie, die werd uitgevoerd in samenwerking met de onderzoeksgroep van professor Bernd Engels van het JMU Instituut voor Fysische en Theoretische Chemie, zal worden gepubliceerd in het befaamde Wetenschap tijdschrift.
 Hoe PH van bufferoplossingen te berekenen
Hoe PH van bufferoplossingen te berekenen Corrosie en chemische veranderingen in aluminium Metal
Corrosie en chemische veranderingen in aluminium Metal Mechanische eigenschappen van zacht staal
Mechanische eigenschappen van zacht staal Vegan spinzijde biedt duurzaam alternatief voor plastic voor eenmalig gebruik
Vegan spinzijde biedt duurzaam alternatief voor plastic voor eenmalig gebruik Ontwerpen van selectieve membranen voor batterijen met behulp van een toolbox voor het ontdekken van medicijnen
Ontwerpen van selectieve membranen voor batterijen met behulp van een toolbox voor het ontdekken van medicijnen
 Beter gebruik maken van aardobservaties om terrestrische en mariene ecosystemen te verbeteren
Beter gebruik maken van aardobservaties om terrestrische en mariene ecosystemen te verbeteren Geschiedenis van Northwest Passages gekenmerkt door gevaren, dood
Geschiedenis van Northwest Passages gekenmerkt door gevaren, dood Waterstrateeg beantwoordt vragen over het beheer van onze kostbare waterbronnen
Waterstrateeg beantwoordt vragen over het beheer van onze kostbare waterbronnen Zeldzame aardelementen en oude mijnen zorgen voor problemen voor de watervoorziening in het westen van de VS
Zeldzame aardelementen en oude mijnen zorgen voor problemen voor de watervoorziening in het westen van de VS Belangrijkste bosbranden in Portugal onder controle (update)
Belangrijkste bosbranden in Portugal onder controle (update)
Hoofdlijnen
- De verbazingwekkende diversiteit – en mogelijk verval – van paddenstoelen en andere schimmels
- Paarden kunnen onze lichaamstaal lezen, zelfs als ze ons niet kennen
- Virtual reality blaast Afrikaanse fossielen nieuw leven in kunst en artefacten
- Is er verteld dat je te gevoelig bent? Je zou een empaat kunnen zijn
- Vissen gebruiken doofheidsgen om waterbeweging waar te nemen
- De verschillen tussen mannelijke pollen en vrouwelijke zaden dennenappels
- Waarom zijn de roze meren van Australië roze?
- Deze 8 foto's van puppy's kunnen je helpen focussen,
- Bloedbad vreest race om zeldzame Australische papegaai te redden
- IJsbestendige coating voor grote constructies is afhankelijk van een prachtige demonstratie van mechanica

- Palladiumkatalysator versnelt twee afzonderlijke reacties, bruikbare moleculen maken in één proces
- NIST-software helpt bij de analyse van geïnstrumenteerde charpy-tests
- Rekbare zonnecellen een stap dichterbij

- Zelfreinigend beton kan gebouwen er als nieuw uit laten zien

 Zilvernanodeeltjesconcentratie te laag om schadelijk te zijn in de watervoorziening, papieren vondsten
Zilvernanodeeltjesconcentratie te laag om schadelijk te zijn in de watervoorziening, papieren vondsten UK om de ontwikkeling van de tweede Scout-missie te leiden, HydroGNSS
UK om de ontwikkeling van de tweede Scout-missie te leiden, HydroGNSS Moleculen in collectieve extase
Moleculen in collectieve extase Wetenschappers maken plastic van suiker en koolstofdioxide
Wetenschappers maken plastic van suiker en koolstofdioxide Haptische onderzoekers ontdekken dat de biomechanica van de huid nuttige tactiele berekeningen kan uitvoeren
Haptische onderzoekers ontdekken dat de biomechanica van de huid nuttige tactiele berekeningen kan uitvoeren Nokia schrapt meer banen omdat snelle netwerkdeals langzaam komen
Nokia schrapt meer banen omdat snelle netwerkdeals langzaam komen Zijn er nu meer overstromingen dan vroeger?
Zijn er nu meer overstromingen dan vroeger?  Gemeenschappelijke Mississippi Spiders
Gemeenschappelijke Mississippi Spiders
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

