
Wetenschap
Eiwitstructuur zou nieuwe behandelingen voor cystische fibrose kunnen ontsluiten
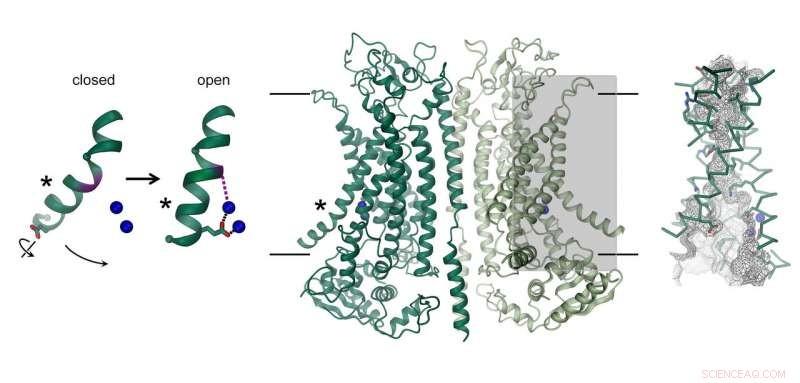
Structuur van het door calcium geactiveerde chloridekanaal TMEM16A. Het kanaal, die bestaat uit twee identieke subeenheden, wordt weergegeven in het midden. De positie van het membraan is aangegeven met lijnen. De ionengeleidingsporie is gemarkeerd (grijze rechthoek) en wordt rechts in detail weergegeven. De afbeelding links toont de beweging van een α-helix die naar de kanaalopening leidt. Gebonden calciumionen worden weergegeven als blauwe bollen. Krediet:Raimund Dutzler, UZH
Biochemici van de Universiteit van Zürich hebben cryo-elektronenmicroscopie gebruikt om de gedetailleerde architectuur van het chloridekanaal TMEM16A te bepalen. Dit eiwit is een veelbelovend doelwit voor de ontwikkeling van effectieve geneesmiddelen voor de behandeling van cystische fibrose.
Cystic fibrosis is een ernstige erfelijke ziekte van de long, waarvoor momenteel geen remedie bestaat. De onderliggende oorzaak van de ziekte is een storing van het chloridekanaal CFTR, die de afscheiding van chloride in bepaalde lichaamscellen voorkomt. Dit leidt tot uitdroging van de slijmlaag in de longen. Een veelbelovende benadering voor de behandeling van cystische fibrose is de activering van het calcium-geactiveerde chloridekanaal TMEM16A als een alternatieve route voor chloride-efflux. Aangezien TMEM16A tot expressie wordt gebracht in hetzelfde epitheel als CFTR, de activering ervan zou de hydratatie van de slijmlaag kunnen herstellen. TMEM16A maakt deel uit van een eiwitfamilie waarvan de leden de stroom van negatief geladen chloride-ionen of lipiden door het celmembraan vergemakkelijken.
Structuur van een chloridekanaal bepaald
De structuur van een TMEM16 scramblase, die functioneert als een lipidentransporteur en een belangrijke rol speelt bij de bloedstolling, was al bekend van eerder werk. Onderzoekers van de afdeling Biochemie van de Universiteit van Zürich zijn er nu ook in geslaagd de structuur van het chloridekanaal TMEM16A te ontcijferen. Om dit te doen, het team onder leiding van professor Raimund Dutzler gebruikte cryo-elektronenmicroscopie (cryo-EM), een techniek waarvan de pioniers onlangs de Nobelprijs voor de Scheikunde kregen. "De moleculaire architectuur van dit membraaneiwit is cruciaal voor de gerichte ontwikkeling van geneesmiddelen voor de behandeling van cystische fibrose, " benadrukt Dutzler.
Ontdekking van een nieuw activeringsmechanisme
Het chloridekanaal TMEM16A is te vinden in verschillende organen van het lichaam en speelt een sleutelrol bij de afscheiding van chloride in de longen, de samentrekking van gladde spieren, en de perceptie van pijn. Hoe de structuur verschilt van nauw verwante scramblases van dezelfde familie en hoe het eiwit wordt geactiveerd door calcium, werd nu onthuld door een combinatie van cryo-EM en elektrofysiologie. Hoewel de algemene architectuur lijkt op scramblases van dezelfde familie, er zijn duidelijke verschillen in het poriegebied dat zich in elke subeenheid van het dimere eiwit bevindt. Scramblases bevatten een aan het membraan blootgestelde polaire groef, wat de diffusie van lipidekopgroepen over de lipidedubbellaag mogelijk maakt. In tegenstelling tot, op dezelfde locatie, TMEM16A vormt een zandlopervormig eiwit-omsloten kanaal, die gesloten is in afwezigheid van calcium. De binding van positief geladen calciumionen in de buurt ervan opent het kanaal en laat negatief geladen chloride-ionen door het membraan doordringen. "Dit activeringsmechanisme is uniek, aangezien de gebonden calciumionen direct de structuur en elektrostatica van de ionenpermeatieporie veranderen, " legt Cristina Paulino uit, hoofdauteur van de studie.
De weg vrijmaken voor nieuwe therapieën
De bevindingen die de structuur en functie van TMEM16A beschrijven, maken de weg vrij voor een mechanistisch begrip van deze belangrijke familie van membraaneiwitten, en ze bieden een veelbelovende sjabloon voor het ontwikkelen van medicijnen voor de behandeling van cystische fibrose. "Stoffen die leiden tot de activering van de TMEM16A zouden het defect in de afscheiding van chloride-ionen in de longen compenseren, ", zegt Raimund Dutzler.
 Hoe schadelijk zijn nano-koper en antischimmelcombinaties in de waterlopen?
Hoe schadelijk zijn nano-koper en antischimmelcombinaties in de waterlopen? Onderzoek toont aan dat afzonderlijke atomen efficiëntere katalysatoren kunnen maken
Onderzoek toont aan dat afzonderlijke atomen efficiëntere katalysatoren kunnen maken Zelfherstellend membraan voor papieren documenten voor brandstofceltoepassingen
Zelfherstellend membraan voor papieren documenten voor brandstofceltoepassingen Mechanisme dat verantwoordelijk is voor het maken van gehalogeneerde organische verbindingen bij fracken ontdekt
Mechanisme dat verantwoordelijk is voor het maken van gehalogeneerde organische verbindingen bij fracken ontdekt Hoe te testen op zoutzuur
Hoe te testen op zoutzuur
 Behandeld hydraulisch brekend afvalwater kan waterbronnen in de omgeving jarenlang vervuilen
Behandeld hydraulisch brekend afvalwater kan waterbronnen in de omgeving jarenlang vervuilen Orkaan Irma meest duurzame superstorm ooit:Franse weerdienst
Orkaan Irma meest duurzame superstorm ooit:Franse weerdienst Blootstelling van brandweerlieden aan natuurbrandrookverbindingen varieert afhankelijk van de taken
Blootstelling van brandweerlieden aan natuurbrandrookverbindingen varieert afhankelijk van de taken Een kleine cirkel in Azië bevat meer dan de helft van de wereldbevolking
Een kleine cirkel in Azië bevat meer dan de helft van de wereldbevolking  Europa's oudste meer sporen 1,36 miljoen jaar klimaat
Europa's oudste meer sporen 1,36 miljoen jaar klimaat
Hoofdlijnen
- Wat levert elektronen voor de lichtreacties?
- Onderzoekers vinden dat er minstens 14, 003 plantensoorten in het Amazonebekken
- Onderzoekers ontdekken hoe cellen decennia later infecties onthouden
- Een dodelijke schimmel die het witte-neussyndroom veroorzaakt, kan een achilleshiel hebben, studie onthult
- Invasieve wormen verspreiden zich in arboretumbossen, beperkte effecten tot nu toe
- Computerprogramma detecteert verschillen tussen menselijke cellen
- Nieuw onderzoek onthult de enige tuimelaars in Engeland
- Daar is een studie over:het stenen tijdperk had net zoveel linkse mensen
- DNA-replicatie vergelijken en contrasteren in prokaryoten en eukaryoten
- Noedels verrijkt met voedingsvezels door geavanceerde technologie blijven lekker
- Een nabij-infrarood fluorescerende kleurstof voor bio-imaging op lange termijn
- De strijd tegen tandbederf krijgt hulp met een nieuw slim materiaal

- COVID-19-antilichaamtesten:hoe betrouwbaar zijn ze?

- Chemici tonen aan dat het 18-elektronenprincipe niet beperkt is tot overgangsmetalen
 Onderzoekers publiceren een gedetailleerd beeld van de stroom van biologische deeltjes in de diepzee langs de evenaar
Onderzoekers publiceren een gedetailleerd beeld van de stroom van biologische deeltjes in de diepzee langs de evenaar Onderzoekers dringen er bij de wetenschappelijke gemeenschap op aan #StopPandemicBias
Onderzoekers dringen er bij de wetenschappelijke gemeenschap op aan #StopPandemicBias Een hydrologisch model leidt tot vooruitgang bij het maken van een wereldwaterkaart
Een hydrologisch model leidt tot vooruitgang bij het maken van een wereldwaterkaart Snelle en eenvoudige experimenten met magneten
Snelle en eenvoudige experimenten met magneten  Stadsbomen leven snel, sterven jong in vergelijking met die in landelijke bossen
Stadsbomen leven snel, sterven jong in vergelijking met die in landelijke bossen Wetenschappers creëren gouden nanodeeltjes die krachtige radioactieve deeltjes rechtstreeks naar tumoren transporteren voor behandeling
Wetenschappers creëren gouden nanodeeltjes die krachtige radioactieve deeltjes rechtstreeks naar tumoren transporteren voor behandeling Een keuze tussen thuis en werk – hoe genderongelijkheid op het werk ervoor zorgt dat vrouwen zelden alles kunnen hebben
Een keuze tussen thuis en werk – hoe genderongelijkheid op het werk ervoor zorgt dat vrouwen zelden alles kunnen hebben Wetenschappers gebruiken gewoon glas om de elektronische eigenschappen van grafeen te optimaliseren
Wetenschappers gebruiken gewoon glas om de elektronische eigenschappen van grafeen te optimaliseren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

