Wetenschap
Hoe bepaalt u hoeveel punten zich op een elementen bevinden Lewis Dot Structuur
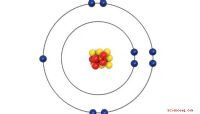
Lewis-stipstructuren vereenvoudigen de methode om aan te geven hoe binding optreedt in covalente moleculen. Chemici gebruiken deze diagrammen om de associatie van valentie-elektronen tussen gebonden atomen te visualiseren. Om een Lewis-stipstructuur voor een atoom te tekenen, moet je weten hoeveel valentie-elektronen een atoom bezit. Het periodiek systeem ordent de elementen op basis van de gelijkenis van hun chemische eigenschappen. Een van de eigenschappen die aan een element is gekoppeld, is het aantal andere atomen waarmee het moleculen vormt en hoeveel verschillende bindingen waaraan het kan deelnemen. De eerste twee kolommen en de laatste zes kolommen van het periodiek systeem geven de s- en p-orbitalen aan die de valentie-elektronen bevatten en nemen deel aan de vorming van covalente bindingen.
Zoek het element op het periodiek systeem. Lewis-stipstructuren zijn vereenvoudigde weergaven van de valentie-elektronen voor elementen. De locatie op het periodiek systeem geeft aan hoeveel valentie-elektronen het element bezit.
Teken het symbool voor het gewenste element. De valentieschalen voor de meeste elementen hebben ruimte voor acht elektronen, behalve waterstof en helium, die twee elektronen kunnen herbergen. Overgangsmetalen hebben ruimte voor 18 elektronen maar houden zich niet aan de octetregel die door andere elementen wordt nageleefd. Ze vormen coördinatiecomplexen met andere atomen.
Identificeer de positie voor de valentieschalen op het elementsymbool. Plaats de elektron-orbitalen aan beide zijden, boven en onder het symbool van het element voor atomen die alleen betrokken zijn bij enkelvoudige bindingen. Voor moleculen met dubbele bindingen liggen de orbitalen 120 graden uit elkaar en houdt één van de drie orbitalen twee elektronen vast voor de dubbele binding. In het geval van moleculen met drievoudige bindingen is het molecuul lineair en heeft de zijde van het atoom die betrokken is bij de drievoudige binding drie elektronen. Elk van de orbitalen is in staat om twee elektronen vast te houden.
Tel het aantal posities van de meest linkse kolom van het periodiek systeem tot de positie van het element. De eerste twee kolommen en de laatste zes kolommen van de tabel geven de elementen aan die valentie-elektronen bevatten. De elementen in het overgangsmetaalgebied van de tafel hebben valentie-elektronen, maar hun binding is gecompliceerder dan de andere elementen.
Plaats het aantal elektronen dat u hebt bepaald in de orbitalen rond het symbool van het element. Plaats een enkel elektron in elke baan voordat je een tweede elektron in een andere orbitaal plaatst. In moleculen die dubbele of driedubbele bindingen hebben, bevinden de twee of drie elektronen die betrokken zijn op beide atomen die betrokken zijn bij de dubbele of drievoudige binding zich tussen de twee atomen.
Hoofdlijnen
- Hoe beïnvloedt de temperatuur het metabolisme?
- Komt mitose voor in Prokaryoten, Eukaryoten of Beide?
- Plasmamembraan: definitie, structuur en functie (met diagram)
- Cheerleaders helpen bij het ontdekken van bacteriën die beter groeien zonder zwaartekracht
- Biologische experimenten op de gisting van gist
- Voordelen van embryonale stamcelonderzoek
- Hoe celstructuren te identificeren
- Wat is de structuur van stamcellen?
- Drie voorbeelden van een enkelvoudig allel-kenmerk
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com